最新的显微技术使研究人员一探细胞内部的奥秘,解密细胞错综复杂的精美结构。
撰文 | Diana Kwon
翻译 | 施普林格·自然上海办公室
在2017年有几周时间,Wanda Kukulski对一种独特的影像着了迷:细胞内部视频。这是用冷冻电子断层扫描技术(cryo-ET)制作的视频,让研究人员能以高分辨率观察细胞内蛋白质。在这些视频里她能看到种种奇观,比如细胞内部的运作和区室等,详细程度前所未有。“我惊叹于这里的美学与复杂性,那些个晚上我都像在看纪录片一样盯着它们。”Kukulski回忆道。她是瑞士伯尔尼大学的生物化学家。
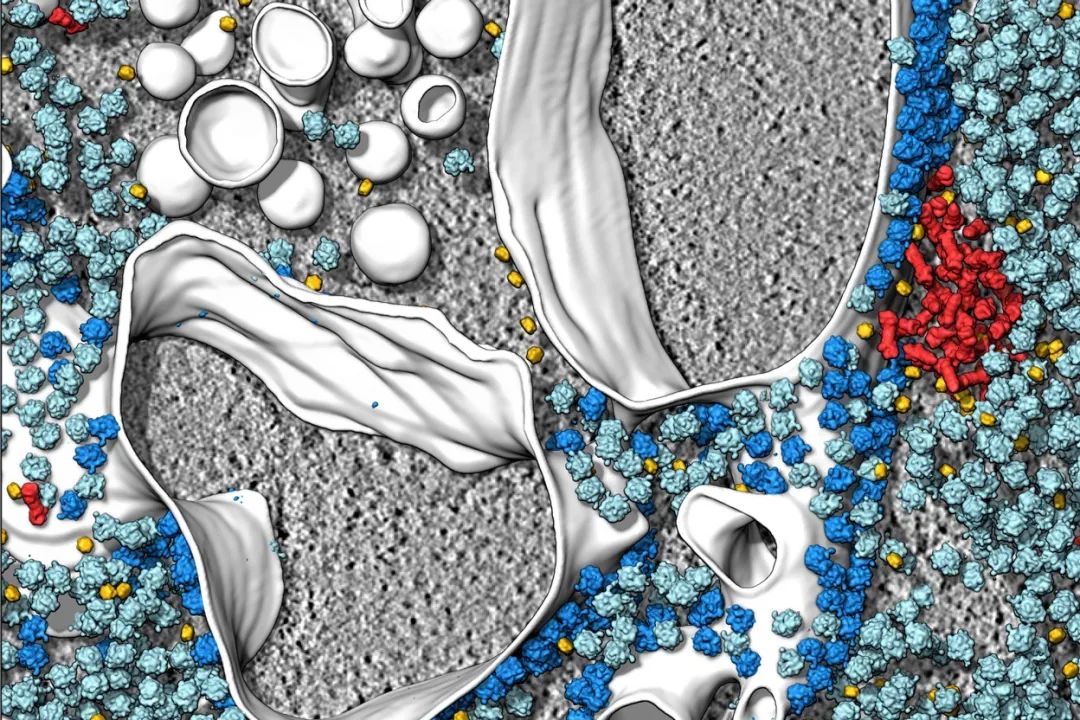
冷冻电子断层扫描等相关技术,极富细节地展现了细胞内部结构。图源:S. Albert et al./PNAS (CC BY 4.0)
近些年,类似cryo-ET的成像技术已使科学家们开始能观察生物分子在其原始环境中的样子。这类技术不同于以往的方法,不需要把单个蛋白质分离后再研究,而是整体地观察蛋白质等分子和其所处细胞的环境。虽说这类技术仍有不足,比如有些研究人员认为cryo-ET的分辨率还是太低,确定分子的把握不大;但这种技术正日益受青睐,也越来越先进。使用这类技术的研究人员,不仅沉迷于它获取的精美图片,而且惊讶于它揭示的那些秘密——比如细菌用于感染细胞的把戏,或突变蛋白如何导致了帕金森等神经退行性疾病。加州理工大学的结构生物学家Grant Jensen说,通过显微镜每一次观察,都是再一次探索未知细胞结构的机会。“能第一次看到的时候绝对是大喜过望。”他说。其他研究人员也深有同感。Elizabeth Villa是加州大学圣迭戈分校的生物物理学家,她回忆自己第一次用cryo-ET观察细胞结构时的巨大兴奋。“就好像突然之间,我们自己成了(细胞)狗仔队,拿到了从没有过的大料。”
从晶体到环境几十年来,研究人员都依靠X线晶体成像技术观察蛋白质、病毒及其他生物物质。这种技术需要诱导分子形成静态有序的晶体结构,然后用强X射线轰击样品。X线晶体成像技术使人们发现了DNA螺旋结构和10万余个蛋白质结构, 但它有自己的缺点:分子晶体化过程困难、冗长,而且有些时候不可能实现。
使用冷冻电子显微镜(cryo-EM)技术,科学家克服了这些缺点。这种技术显示的是分离、冷冻后的生物分子结构。cryo-EM的样品会经电子束照射。一开始这种技术产生的图像过于模糊而被嘲笑是“一坨成像”(blobology),但后来样品准备和图像处理算法的进步提高了分辨率,使其足以观察单个原子(约1.2埃,即1.2 × 10–10 大小,参见:打开全新“视”界:冷冻电镜成像技术首达原子分辨率)。随着“分辨率革命”席卷cryo-EM,到2013年前后科学家大多都用上了这一方法。截至目前,研究人员用冷冻电镜已经解开了1万多个生物分子的结构。其中细胞膜蛋白尤为受人关注,因为很多膜蛋白对于理解疾病、开发新药都至关重要。这些进步“为那些有才华的人打开了一扇门,在下一个内容丰富、技术成熟的领域中追寻重大进展”,Jensen说。这个领域正是cryo-ET。cryo-ET早期支持者追求的是这么一种技术:它不仅能观察生物分子的精微细节,还能观察其在细胞内的样子。cryo-ET和cryo-EM一样,都需要电子显微镜,并且依赖于同一种样品准备方法:玻璃化,即快速冷却样品周围的水分,样品冷冻后形成玻璃态而非冰晶体。但与cryo-EM的不同之处在于,传统冷冻电镜需要纯化样品,而研究人员能用cryo-ET拍摄分子原位图像(伴周围环境)。

上图为cryo-ET观察得到的海藻细胞内部结构,图示内质网(黄色),功能为合成蛋白质;高尔基体(Golgi apparatus)的囊袋(绿色、紫红色),修饰和装配转运蛋白;囊泡(小的圆形结构,多种颜色示),运输蛋白。图源:Y. S. Bykkov et al./eLIFE (CC BY 4.0)
科学家可用cryo-EM合成三维图像,通过先拍摄孤立分子不同构型的二维图像,再进行合成。但有了cryo-ET,他们就能多角度拍摄单块富分子材料,这样一来,分子的周围环境便可保持完整。这就像给一群人拍集体照而不是给一个人拍大头照。所以马克斯·普朗克生物化学研究所的生物物理学家Wolfgang Baumeister和同事给cryo-ET起了个绰号,叫它“分子社会学”。他是这项技术的先驱之一。毕竟,伴有周围环境的蛋白质才是它生活的状态。“蛋白质也有社会:一个蛋白质分子,每时每刻都和十来种其他蛋白生活在复合物里,” Villa说。在用cryo-ET看过分子间相互作用之后她补充道,“想到自己再要研究单独的蛋白,我都受不了了。”电子断层成像技术(即用电子显微镜从几个角度给一份样品成像)本身早在20世纪60年代就有了,但直到90年代,这种技术才开始显出价值。一个难题是,电子束极为损伤生物样品,所以很难用它拍到足够多的快照以获取清晰干净的图像。科学家们用最新的样品切片处理技术和计算方法,现在已经让图像清晰多了。例如,冷冻聚焦离子束(cryo-FIB)减薄技术,就能把样品切到极薄,称为薄层片(lamellae)。但是,使用cryo-ET高昂成本和技术要求(特别是联用离子减薄这类技术的情况下)让很多实验室望而却步,Baumeister说。
Baumeister团队初期使用cryo-ET得到了盘基网柄菌属(Dictyostelium)细胞的图片[1],这是一种生活在土壤中、以细菌为食的阿米巴原虫。该团队揭示了许多阿米巴细胞的特征,包括前所未知的、塑造细胞骨架的复杂蛋白质网络特点,如单个微丝间如何相互作用、如何结合到其细胞膜的特定结构上。“很少能给单个的分子划分它对应的生物或细胞功能,大多数功能来自于同处一种细胞环境下所有分子的相互作用,” Baumeister说。“这就是cryo-ET的发现潜力所在。只要观察就有惊喜。”
社会细胞cryo-ET早期成果大多在原核生物领域,如细菌这样的单细胞生物。这些细胞一般比真核生物的细胞要小、要薄,而且没那么复杂。
例如,Jensen及其团队2006年发表的研究中,首次报道了鞭毛马达(motor)的完整结构。鞭毛是一种鞭状的细菌附属物[2]。他们团队使用cryo-ET技术,揭示了白蚁肠道细菌Treponema primitia的鞭毛马达20个部分的架构方式,并得到了这些部分在细菌膜上的位置细节。Jensen团队还发现了细菌纤毛的重要细节信息——纤毛为微生物凸起部分,有很多功能,如与其感染的细胞结合,以及向其中分泌物质。就在去年,他们发表了一本开放获取的数字图册(详见),着重介绍了cryo-ET为细菌等原核生物带来的见解。科学家最近开始转向真核细胞成像,它们跟原核细胞相比堪称殿堂般宏伟。实现真核细胞成像,主要得益于离子减薄技术。这项技术能让研究人员先把细胞切薄后,再放到电子显微镜下观察。Baumeister团队用这种复合技术,观察到了人体细胞核周围分子排布的方式[3](见“细胞内部抢先观”)。他们的工作发现了一种纳米级新细丝,并揭示了其支撑细胞核结构的方式——把细胞核打造成了动物细胞中最为坚固的细胞器之一。
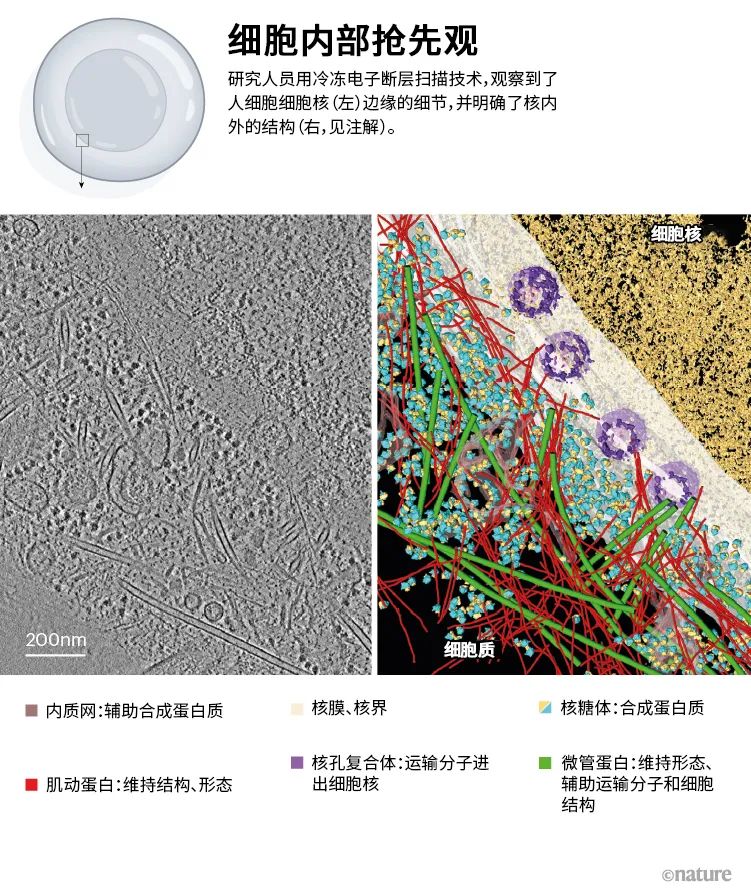
图源:参考文献[3]
即便cryo-ET联合离子减薄术,也只能观察真核细胞很小的一部分,这就意味着科学家想要在细胞的汪洋大海中确定他们感兴趣的分子,就需要另寻他法。一种解决方法是先荧光标记蛋白,然后在光学显微镜下观察定位蛋白,之后再用cryo-ET放大特定部分、获取这部分的精细图像。Villa团队用上述组合技术,解出了LRRK2蛋白的结构。这种蛋白关系着帕金森病的遗传形式[4]。他们的结果表明,突变蛋白紧密结合细胞骨架组分中的微管蛋白,在其周围形成了双螺旋结构。该团队还发现,突变型LRRK2形成的构型,可能会促进上述结合——阻断了携带重要细胞货物的分子沿微管的运输,因此可能导致疾病[5]。Baumeister团队利用该方法研究神经退行性疾病如亨廷顿舞蹈病[6],和运动神经元病(肌萎缩性侧束硬化症,或称ALS)[7],检测了上述疾病相关的蛋白质与内质网(ER)等细胞组分的相互作用。ER这个大型细胞器辅助合成蛋白质。研究人员发现,上述两类疾病中神经毒性蛋白团块,其细胞内的生物行为截然不同。比如亨廷顿舞蹈病的突变型蛋白聚体亨廷素(huntingtin),会把ER的组织架构变得杂乱无章,但ALS中的异常蛋白聚体则不同,它会激活细胞蛋白降解程序,从而破坏细胞的生物化学性质。科学家们希望,今后能用这种方法观察药物在细胞分子内部的作用方式,深入理解各种疗法的起效方式。Julia Mahamid在德国海德堡欧洲分子生物学实验室工作,在一个初期展示中,她的团队成功看到了细菌细胞内抗生素结合核糖体的过程——核糖体是细胞内的蛋白质车间[8]。这项成就要归功于cryo-ET的分辨率被提高到了3.5埃。“我觉着这大概就是(cryo-ET的)最尖端了吧,” Kukulski说。她未参与此项工作。但她指出,核糖体遍布细胞、特征鲜明,因此易于识别和研究,并补充说,对那些所知甚微或数量稀少的细胞结构,成像工作仍然相当困难。
强有力的组合虽然cryo-ET领域发展迅猛,但是这项技术仍有很多局限。分辨率不够还是个大问题。虽然细节度近年来大幅提高,但是cryo-ET还达不到cryo-EM那样原子水平的分辨率。“cryo-ET还处在cryo-EM上世纪90年代初的水平,要实现原子级分辨率还需要很长时间,”加州大学洛杉矶分校的生物物理学家Hong Zhou 说。
据Zhou说,cryo-ET现有的分辨率难以正确识别细胞内的分子。所以,科学家只能观察像核糖体这种之前解析良好的结构,否则他们据此观察到的内容提出假设,可能最终发现是错的,他又说:“(现在)赢面不大,很容易出错。”
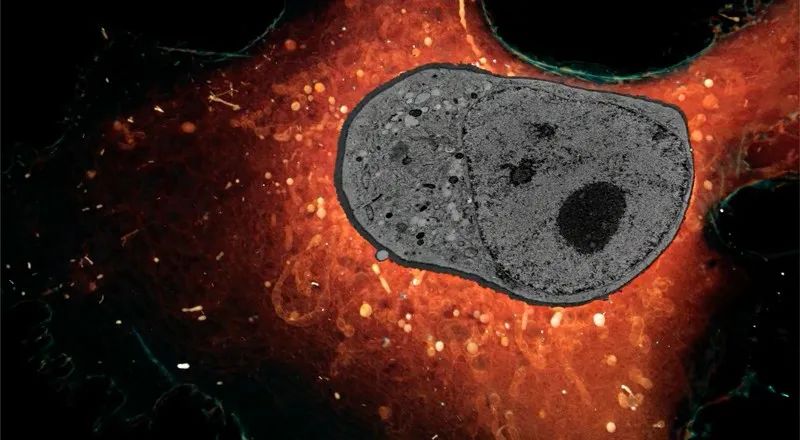
完整细胞切成薄片后,在超高分辨率显微镜的图像。图源:Janelia Research Campus HHMIZhou
为了规避分辨率的问题,转而尝试突破传统cryo-EM的极限分辨率。他的团队最近报道了cyroID技术[9],以cryo-EM与其他多种技术联用。其中一种是把细胞打开,并让蛋白质部分保留在原来的细胞环境中;如此一来,研究人员就可以在近自然态下观察蛋白质了。虽然Zhou现在的工作重点在cryo-EM,但他说cryo-ET才是未来的发展方向。“我觉得(该方法)是实现这个目标的中间步骤。”cryo-ET另一局限在于取样范围窄。“断层扫描技术有个秘密,那就是一张哺乳动物细胞断层扫描图,只能观察不到0.1%的细胞。” Villa说。这就意味着细胞核这样的大型细胞器只能一小块一小块地观察。为了弥补这个缺点,Harald Hess这样的科学家另寻他法,即使用超高分辨荧光显微镜联合电子显微镜共同观察完整细胞。Hess是美国霍华德·休斯医学研究中心珍妮莉亚研究园区的生物物理学家。他的团队用上述方法,得到了多种细胞组分互作的清晰图像[10]。本月早些时候发表的文献中,研究人员证实用机器学习(人工智能的一种形式)辅助确定多个样品中的细胞组分,能描绘多达35种细胞器的组织[11]。其他研究人员在做cryo-ET和X射线断层扫描技术的联合,来拍摄完整细胞的图像。这种组合让科学家们能观察稍大的细胞组分,比如线粒体、核仁的结构,继而放大观察他们感兴趣的特定区域。但是,联合使用这些方法,耗资大、技术要求高。除了这两点外,两项技术都会用破坏性射线强烈照射样品。这让在二者间转移样品变得很困难,Eva Pereiro说。他是一名在西班牙巴塞罗那ALBA同步辐射光源站工作的束线科学家,该站可生产适用于断层扫描的X射线。某些实验室已经实现了样品转移。Maria Harkiolaki是英国迪考特市同步辐射光源站“钻石”光源的首席束线科学家。她的团队最近发表了新型冠状病毒(SARS-CoV-2)感染机制的模型[12],解析这一过程用的就是cryo-ET联合X线断层扫描技术。他们在细胞和单分子两个水平都拍摄了病毒感染过程,并提出了病毒在灵长类细胞内复制过程的假设。Baumeister认为,cryo-ET会跟cryo-EM一样,最终能让科学家在原子水平上观察生物分子。在此之前,科学家会持续热忱地研究cryo-ET等类似方法显示的细胞内图景。因为这些工具能揭示前所未见的结构,所以研究人员常常有新的谜题需要解决。“关于断层扫描我最爱的部分,” Villa说:“就是问题总比答案多。”
参考文献
[1] Medalia, O. et al. Science 298, 1209–1213 (2002).
[2] Murphy, G. E., Leadbetter, J. R. & Jensen, G. J. Nature 442, 1062–1064 (2006).
[3] Mahamid, J. et al. Science 351, 969–972 (2016).
[4] Watanabe, R. et al. Cell 182, 1508–1518 (2020).
[5] Deniston, C. K. et al. Nature 588, 344–349 (2020).
[6] Bäuerlein, F. J. B. et al. Cell 171, 179–187 (2017).
[7] Guo, Q. et al. Cell 172, 696–705 (2018).
[8] Tegunov, D., Xue, L., Dienemann, C., Cramer, P. & Mahamid, J. Nature Methods 18, 186–193 (2021).
[9] Ho, C.-M. et al. Nature Methods 17, 79–85 (2020).
[10] Hoffman, D. P. et al. Science 367, eaaz5357 (2020).
[11] Heinrich, L. et al. Nature (2021).
[12] Mendonça, L. et al. Nature Commun. 12, 4629 (2021).
本文经授权转载自微信公众号“Nature Portfolio”。原文以The secret lives of cells — as never seen before为标题发表在2021年10月26日《自然》的新闻特写版块上。原文链接:
0
推荐




 京公网安备 11010502034662号
京公网安备 11010502034662号 