阅读:0
听报道
是否需要打第三针疫苗加强针?什么人应该打?什么时候打最好?社交隔离政策应当收紧还是放宽?……其他国家和地区对新冠疫情流行病学数据的密切观察和分析,有助于我们做出适当的防疫决策。
撰文 | 史隽
虽然以色列的新冠疫苗接种率在全世界处于领先地位(已有超过80%的成年人接种了疫苗),但最近一段时间,以色列疫情似有卷土重来的迹象,新冠病毒Delta 变异株的病例急剧增加。据以色列耶路撒冷希伯来大学的报告,15岁以上的新增病例中有90%是已经完成疫苗接种的人。7月23日,以媒称辉瑞疫苗阻止Delta变异株传播的效力仅有39%,但仍可预防重症。
同时,美国各地的新冠病例也有所增加,类似的,也是相当一部分的确诊病例是已经完成疫苗接种的人,通常被称作突破性病例。截至 7 月 17 日,马萨诸塞州统计有 5,166 例突破性病例。其中,272人住院并存活;有 80 人去世,其中23 人没有住院而死亡;57 人在住院后死亡。马萨诸塞州的居民完全接种了疫苗有4,344836 名,占所有居民的63%。
很多医生认为,疫情反复的最大原因是Delta 变异株的传染性是原始毒株的两倍。

图1:新闻报道美国马萨诸塞州新增感染人数增加[1]
个人认为,这一波疫情反复可能有以下4个原因:
变异株的传染力增强了。
疫苗的有效率随着时间减弱了。
疫苗对变异株的有效性减弱了。
接种了疫苗的人更容易大意,不注重基本防护。
除了Delta变异株,目前到底还有哪些变异株值得担心呢?
今年2月初,我曾对当时已经出现的新冠病毒变异株做了一次梳理(详见《新冠病毒变异株大梳理:变异必将继续,人类何去何从?| 117三人行》)。自那以后,又出现几个新的变异株。5月31日,世界卫生组织采用了一个新的系统来命名新冠病毒变异株。
在更改命名之前,这些变异株除了有科学界常用的字母+数字名称,还通常用首次发现它们的国家/地区来提及。例如,首先在英国发现的 B.1.1.7 通常被称为“英国变异株”,而 B.1.351 被称为“南非变异株”,较新的 B.1.617.2 则被称为“印度变异株”。
新的命名系统使用希腊字母,而不是民间常用的国家名称,也不用科学界常用的“字母+数字”模式。这样做,可以避免给这些国家带来污名,另外,希腊字母更易于发音,适合普通大众的讨论,可以避免 “字母+数字”难记的坏处。同时,科学家们将继续使用“字母+数字”的命名系统。
命名系统避免污名化,并不是多此一举。
Delta 变异株在印度被发现,并在世界很多国家迅速传播开后,印度政府要求社交媒体平台删除有关“印度变异株”的内容。世卫组织担心,如果延用旧的命名方式,各国可能会因为顾虑新的变异株要用自己国家的名字来命名,而不愿意报告新变异株。
残酷的事实是:只要新冠病例一天不清零,就会有新的变异株出现。
新的变异株出现以后,科学家们会努力去了解清楚它们的特征,例如:
是否更容易传播?
是否会导致更严重的疾病?
当前可用的病毒测试方法是否能检测到?
对目前的新冠药物反应如何?
以及,目前被批准使用的疫苗对它们的防疫能力有没有减弱?
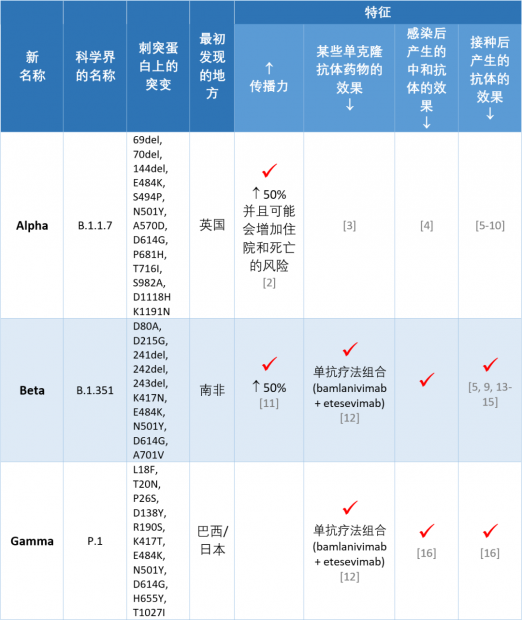
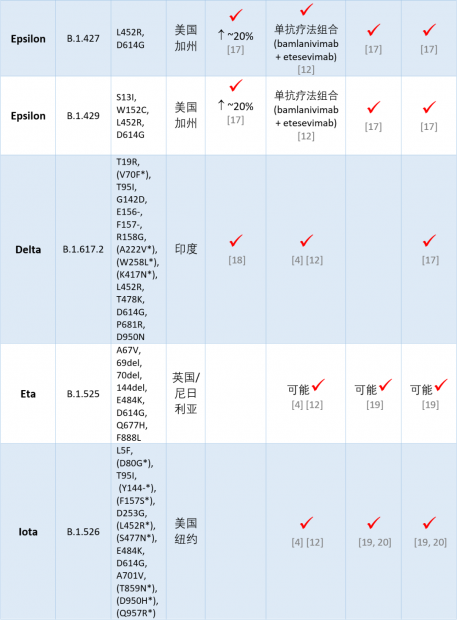
研究表明,到目前为止,新冠病毒有几个在刺突蛋白上的突变特别麻烦。带有这些突变的新冠病毒变异株所引起的病例,可能会让特定的单克隆抗体疗法变得不那么有效。这些突变包括:
L452R突变。在好几个变异株中有。
E484K 突变。在好几个变异株中有。
K417N、E484K 和 N501Y 突变组合。Beta (B.1.351)变异株中存在。
K417T、E484K 和 N501Y 突变组合。Gamma (P.1) 变异株中存在。
目前几个主要的新冠病毒变异株的特性可以用下面这张表格概括:

*引用文章尚未经过同行评审。
我们经常听到Delta 变异株更容易传播的消息,但Delta变异株到底和原来的新冠病毒有什么不同呢?最近一篇新研究进一步分析了这个变异株[23]。
一个病毒传染力增强的原因可能有几种:
从宿主身上脱落得更多。
传染期加长,有更长的时间能从宿主身体脱落去感染别人。
传染性增加,能更好地感染宿主细胞,与细胞表面的受体更好的结合。
在环境中的稳定性增加,更耐湿热等。
研究者调查了中国大陆首次本地传播的Delta变异株感染,采集的167个病例均可追溯到同一个病例源头。流行病学数据分析显示:
暴露于病毒中后,感染 Delta 变异株的人更快地检测出阳性,这表明Delta 变异株在体内增长更快;
感染 Delta 变异株的人在首次检测时,病毒载量比感染2020年原始毒株的人高出 1000 倍。
这表明,与初始毒株相比,Delta变异株的潜伏期缩短了,而且感染者排出(散播)的病毒是过去的1000倍,这会大大增加密切接触者感染的几率。同时,潜伏期缩短也意味着感染Delta变异株后的人能更快具有传染性,就有更多机会感染其他人。也就是说,病毒传播更为高效了。
通过追踪病毒的传播路径并做系统发育分析,这份研究还发现,在这167个病例中,Delta变异株的传播途径有直接接触和间接传播,后者最有可能是通过气溶胶,而非污染物。换言之,Delta变异株的主要传播途径仍然是直接接触和气溶胶间接传播,而不是坊间传说的“更容易在空气中传播”。
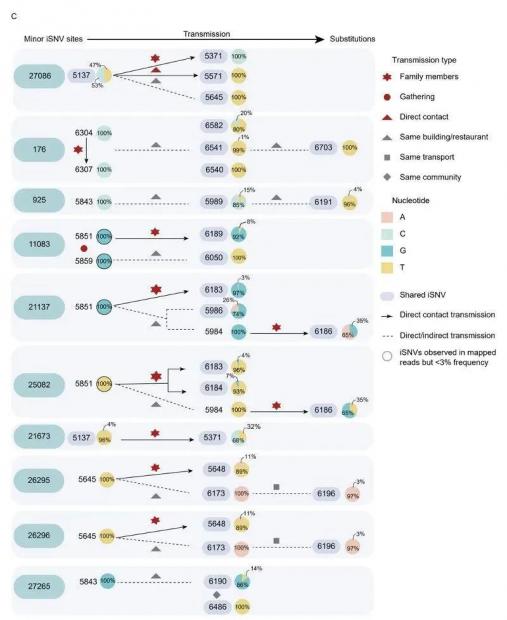
图2. 实线表示高度置信的直接接触传播,虚线表示可能为间接传播[23]。
因此,Delta变异株传播率增加的原因主要有二:病毒量更多,传染速度更快。但传播方式没有变化。
现有疫苗对Delta变异株的有效性究竟如何,不同国家的研究结论也不完全相同。
最近有一项发表在《新英格兰医学杂志》上的研究,基于英国的现实世界数据,证实了英国公共卫生部在 5 月份发表的疫苗功效数据。这项研究发现,在英国,两剂辉瑞新冠疫苗接种完成后,预防 Delta 变异株引起的有症状病例的有效率为 88%,而对 Alpha 变异株的有效率为 93.7%。两针牛津-阿斯利康疫苗对 Delta 变异株的有效率为 67%,对 Alpha 变异株的有效率为 74.5%[24]。
而一项来自以色列的小规模研究的初步数据表明,最近几周,辉瑞疫苗预防新冠感染的效果有所下降。根据以色列卫生部的数据,在 6 月 20 日至 7 月 17 日期间 (具体人数尚未公布),Delta 变异株在以色列新冠病例中占主导地位,辉瑞疫苗两次接种完成后,在降低感染风险方面的有效率为 39%,降低有症状病例的有效率为 40%, 降低住院病例的有效率为 88%,降低重症风险的有效率为91% [25]。
以色列和英国的情况有两点值得考虑:
第一,以色列开始大规模接种的时间较早,疫苗的保护作用可能已经开始下降了。
第二,在英国,辉瑞疫苗两针的间隔是8周以上,而以色列是传统的3周间隔。
英国最初在 2020 年底将辉瑞新冠疫苗两针之间的间隔延长至 12 周。随着疫苗在英国的覆盖率提高,现在这一间隔已缩短到8周。一篇未经同行评审的预印本文章调研了 503 名 英国国家健康机构 (NHS) 工作人员打完辉瑞新冠疫苗以后的免疫反应[26]。这些工作人员在 2020 年底和 2021 年初以不同的时间间隔接受了两次注射,当时Alpha 变异株正在英国迅速传播。第二针的1个月后,研究人员测量了这503人血液中的抗体水平。
研究结果表明:
辉瑞疫苗两针间隔时间无论短还是长,总体上都产生了强烈的免疫反应。
3周疫苗间隔产生的中和抗体比与10 周间隔少。
第一针以后,虽然抗体水平有所下降,但 T 细胞(细胞免疫)的水平仍然很高。
更长的间隔时间虽然导致总T 细胞较少,但其中一个特定的类型,被称为辅助 T 细胞,比例更高。而这种细胞是支持免疫记忆的关键。
这项研究的首席研究员 Susanna Dunachie 教授说,辉瑞疫苗两针比一针好,但两针间隔的时间可以根据情况灵活安排。对于英国目前的情况,她认为8周间隔是最佳时间。
这类对数据的密切观察分析虽然是在以色列、英国和世界其他国家和地区进行的,但是对别的国家的公共卫生政策有着重要的意义。例如,是否、什么时候需要打第三针加强针?需不需要恢复社交隔离?等等问题,都可以借鉴这些国家和地区的数据来做决定。
现有的新冠疫苗是针对还没有这些变异的病毒株研发的。虽然有研究表明现有的新冠疫苗对某些变异株的效力降低了,但这些疫苗似乎仍能预防感染以后的重症。确切的结论还需要进一步的研究,疫苗制造商也在开发针对这些变异株的新疫苗。
参考文献
[1] https://www.nbcboston.com/news/local/more-than-5100-breakthrough-covid-cases-reported-in-mass-at-least-80-have-died/2435719/.
[2] Davies, N.G., et al., Estimated transmissibility and impact of SARS-CoV-2 lineage B.1.1.7 in England. Science, 2021. 372(6538).
[3] https://depts.washington.edu/pandemicalliance/2021/01/25/nervtag-note-on-b-1-1-7-severity/.
[4] https://www.fda.gov/media/145802/download.
[5] Wang, P., et al., Antibody resistance of SARS-CoV-2 variants B.1.351 and B.1.1.7. Nature, 2021. 593(7857): p. 130-135.
[6] Shen, X., et al., SARS-CoV-2 variant B.1.1.7 is susceptible to neutralizing antibodies elicited by ancestral spike vaccines. Cell Host & Microbe, 2021. 29(4): p. 529-539.e3.
[7] Edara, V.V., et al., Infection and mRNA-1273 vaccine antibodies neutralize SARS-CoV-2 UK variant. 2021: p. 2021.02.02.21250799.
[8] Collier, D.A., et al., Sensitivity of SARS-CoV-2 B.1.1.7 to mRNA vaccine-elicited antibodies. Nature, 2021. 593(7857): p. 136-141.
[9] Wu, K., et al., mRNA-1273 vaccine induces neutralizing antibodies against spike mutants from global SARS-CoV-2 variants. 2021: p. 2021.01.25.427948.
[10] https://papers.ssrn.com/sol3/papers.cfm?abstract_id=3779160.
[11] https://cmmid.github.io/topics/covid19/reports/sa-novel-variant/2021_01_11_Transmissibility_and_severity_of_501Y_V2_in_SA.pdf.
[12] https://www.fda.gov/media/145611/download.
[13] Madhi, S.A., et al., Safety and efficacy of the ChAdOx1 nCoV-19 (AZD1222) Covid-19 vaccine against the B.1.351 variant in South Africa. 2021: p. 2021.02.10.21251247.
[14] https://ir.novavax.com/press-releases.
[15] https://www.jnj.com/johnson-johnson-covid-19-vaccine-authorized-by-u-s-fda-for-emergency-usefirst-single-shot-vaccine-in-fight-against-global-pandemic.
[16] Wang, P., et al., Increased Resistance of SARS-CoV-2 Variant P.1 to Antibody Neutralization. 2021: p. 2021.03.01.433466.
[17] Deng, X., et al., Transmission, infectivity, and antibody neutralization of an emerging SARS-CoV-2 variant in California carrying a L452R spike protein mutation. 2021: p. 2021.03.07.21252647.
[18] https://khub.net/documents/135939561/405676950/Increased+Household+Transmission+of+COVID-19+Cases+-+national+case+study.pdf/7f7764fb-ecb0-da31-77b3-b1a8ef7be9aa.
[19] Jangra, S., et al., SARS-CoV-2 spike E484K mutation reduces antibody neutralisation. The Lancet Microbe, 2021. 2(7): p. e283-e284.
[20] Annavajhala, M.K., et al., A Novel and Expanding SARS-CoV-2 Variant, B.1.526, Identified in New York. 2021: p. 2021.02.23.21252259.
[21] Greaney, A.J., et al., Comprehensive mapping of mutations in the SARS-CoV-2 receptor-binding domain that affect recognition by polyclonal human plasma antibodies. Cell Host & Microbe, 2021. 29(3): p. 463-476.e6.
[22] Garcia-Beltran, W.F., et al., Multiple SARS-CoV-2 variants escape neutralization by vaccine-induced humoral immunity. Cell, 2021. 184(9): p. 2372-2383.e9.
[23] https://virological.org/t/viral-infection-and-transmission-in-a-large-well-traced-outbreak-caused-by-the-delta-sars-cov-2-variant/724.
[24] Lopez Bernal, J., et al., Effectiveness of Covid-19 Vaccines against the B.1.617.2 (Delta) Variant. 2021.
[25] https://www.cnbc.com/2021/07/23/delta-variant-pfizer-covid-vaccine-39percent-effective-in-israel-prevents-severe-illness.html.
[26] https://www.pitch-study.org/PITCH_Dosing_Interval_23072021.pdf.
话题:
0
推荐
财新博客版权声明:财新博客所发布文章及图片之版权属博主本人及/或相关权利人所有,未经博主及/或相关权利人单独授权,任何网站、平面媒体不得予以转载。财新网对相关媒体的网站信息内容转载授权并不包括财新博客的文章及图片。博客文章均为作者个人观点,不代表财新网的立场和观点。



 京公网安备 11010502034662号
京公网安备 11010502034662号 