春节假期结束,你又胖了吗?关于肥胖的发生机制,我们本能地会认为是因为吃多了,摄入超过消耗,这就是传统的“能量平衡模型”的说法。但事实上,肥胖的发生机制并不这么简单。近年来科学家提出了“碳水化合物-胰岛素模型”,人们吃了过多的升糖指数高的食物,导致胰岛素分泌增多,促使摄入的糖合成为糖原和脂肪导致肥胖。不过,这一新模型也存在缺陷。要健康减肥,似乎还是那句简单的“管住嘴迈开腿”靠谱,但最简单的,往往也是最困难的。
撰文 | 顾舒晨
每逢佳节胖三斤,遇到春节三公斤。拼命减肥小半年,未到功成又过年。如今,脂肪成为全民公敌。一方面似乎人人都在减肥:你的身边一定有人在跑步、跳操、节食、轻断食,试图减轻体重或者控制腰围的增长;另一方面,人们却在变得越来越胖。
肥胖已经成为全球性重大的公共卫生问题。世界卫生组织指出:脂肪过多会导致多种严重的健康问题,比如心脏病和中风等心血管疾病、二型糖尿病、骨关节炎以及子宫内膜癌、乳腺癌和结肠癌等。肥胖已经成为全球范围内的流行病。世界卫生组织的数据显示,自1975年以来,全球肥胖人口数量几乎增加了两倍。目前超过19亿成年人超重,其中6.5亿人肥胖。而中国已是肥胖人口最多的国家。然而,在公众的视野里,作为疾病的肥胖依然面目模糊。新冠大流行肯定会过去,但肥胖大流行什么时候才能看到隧道尽头的曙光呢?要想解决这个问题,我们首先需要知道人究竟是怎么胖起来的。
更好的肥胖机制模型?
传统的“能量平衡”观念认为,人们变胖是因为他们摄入的卡路里比消耗的多,如果摄入少就能保持苗条。但事实真的那么简单吗?你是不是有时候觉得自己喝凉水都在长胖呢?
2021年9月14日,一项由17位国际知名专家组成的研究团队在The American Journal of Clinical Nutrition发表的研究打破了传统的观念,他们认为“能量平衡模型”存在根本的缺陷,它忽略了食物对激素和新陈代谢造成的影响。而“碳水化合物-胰岛素模型(CIM)”才能更好地解释肥胖的发生机制,并指导减肥。
他们的核心观点是,肥胖不是仅仅因为吃得太多,而是过多地食用了高GI(血糖指数)、高GL(血糖负荷)和高碳水的食物(特别是精制的、可快速消化的碳水化合物);这些食物会引起较高的胰岛素分泌,从而改变人体的新陈代谢,最终导致脂肪储存、体重增加和肥胖。在低脂饮食的模式下,食物中会含更多高GI可快速消化的碳水化合物,这些食物将促进脂肪储存导致肥胖。而减少摄入这类饮食则有助于达到减肥的目的[1]。
所谓的GI(Glycemic Index)也就是血糖生成指数,是评估食物对餐后血糖影响的指标。它是基于100g的食物来计算的,GI<55为低GI食物;55-70为中GI食物;GI>70为高GI食物。根据《中国1型糖尿病诊治指南》的数据,我们中国人平时吃的主食100g米饭的GI约为83,100g富强粉馒头约为88。这类食物进入胃肠后消化快,吸收率高,葡萄糖释放快,能导致血糖快速升高。因此,它们也被称为“快碳水化合物”,即快速消化的碳水化合物。与之对应的是低血糖指数食物,它们包括水果、蔬菜、豆类和全谷物等,即食用后在胃肠中停留时间较长,吸收率低,葡萄糖释放缓慢,可以防止餐后血糖升高,它们也被称为“慢碳水化合物”。
血糖负荷(GL,Glycemic load)也是用来衡量血糖水平高低的一个指标,相对于观察含碳水化合物的食物对血糖水平的影响,血糖负荷增加了食用份量的因素。高血糖负荷食物包括含糖食物和饮料、白面包和米饭等。
除了一部分不依赖于进食的微量的基础胰岛素分泌外,另一部分大量的胰岛素分泌是由进食后升高的血糖刺激引起的,因此摄入高GI的快碳水化合物后引起的胰岛素分泌量也更高。胰岛素可以作用于人体的多个器官和组织,但它的核心职责之一就是参与储存食物中的热量,以应付可能的机体供能短缺。当我们食用高GI的碳水化合物时,胰岛素分泌增加,在胰岛素作用下血糖被用于合成糖原和脂肪,使人体血糖水平下降。这种由进食引起的胰岛素分泌能够立刻终止体内原来储存的脂肪、碳水化合物和蛋白质的分解。与此同时,由于身体一直在保存热量会导致大脑“误以为”身体没有获得足够的能量,基础代谢可能会在这一过程中减慢以保存能量。由此带来的结果是即使已经获得了多余的脂肪,但我们可能仍会感觉饥饿。
根据CIM模型的观点,过量的脂肪储存是由餐后胰岛素分泌导致的,因此相应的“肥胖解决方案”即所谓的低碳水化合物、高脂肪或“生酮”饮食,也就是用膳食脂肪取代碳水化合物,从而减少餐后胰岛素的分泌。这个研究的理论模型并不算新,低碳饮食/生酮饮食减重法早已经横扫全球。但也有许多实验得到了与这一模型相反的结论,在2021年5月的Science杂志中就有文章Carbohydrates, insulin, and obesity批判性地讨论过碳水、胰岛素和肥胖之间的调控关系。该文章认为人类普遍肥胖的主要原因仍然不确定,CIM理论并不能很好地解释最近的一些实验结果[2]。
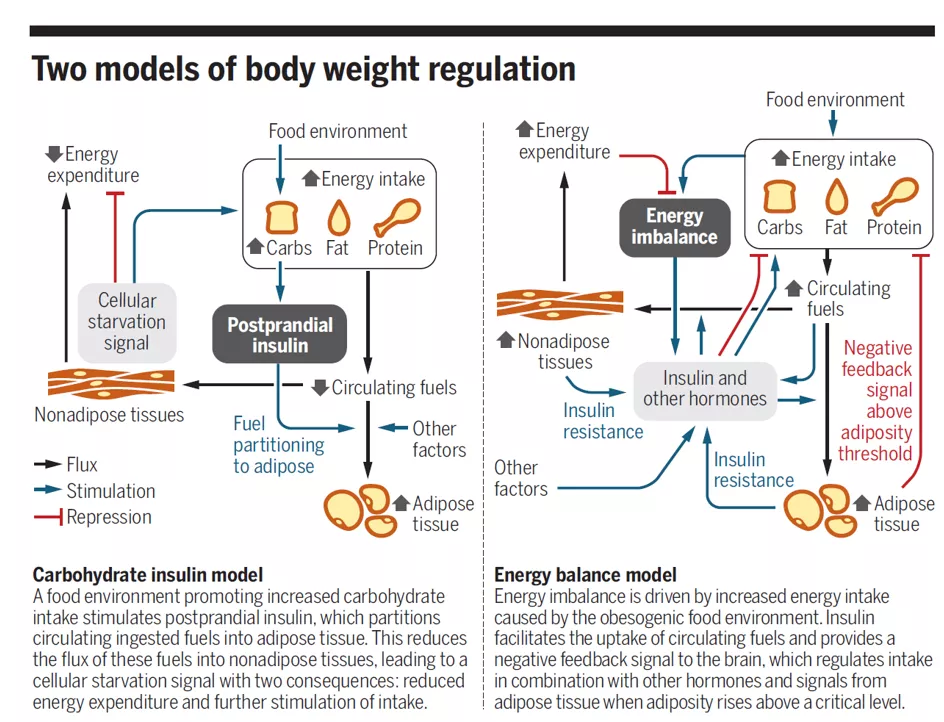
图:左为碳水化合物胰岛素模型,右为能量平衡模型[2]
莫迷信低碳水饮食
在一项小鼠饮食实验中,研究者让实验小鼠食用特定的食物:这些食物中蛋白质含量保持不变,脂肪和碳水化合物含量则在10%至80%之间变化;碳水化合物由玉米淀粉、麦芽糊精和蔗糖的混合物等“高GI”碳水化合物组成。实验共进行了12周,大致相当于人类的9年[3]。如果按照CIM的预测,随着饮食中碳水化合物的增加,餐后胰岛素也会增加,老鼠终会发展成肥胖症。然而实验结果是,饮食中碳水化合物含量高的老鼠,尽管餐后胰岛素较高,但由于摄入的卡路里总量较少,体重和体脂的增加也较少。
另外一项基于人类饮食的实验也得到了与CIM相反的结果。在这项实验中,研究者通过改变20名成年住院病人的饮食,并分析一个月后他们的新陈代谢情况得出了结论。这些病人会被随机分配由10%碳水化合物加75%脂肪,或10% 脂肪加75%碳水化合物组成的饮食,并告诉他们想吃多少就吃多少直到觉得饱为止[4]。由于参与者在同等饱腹状态下,高碳水化合物的饮食中摄入的总热量低于低碳水高脂肪饮食,因此食用高碳水化合物的参与者不仅没有发胖,体内脂肪含量反而显著减少。还有实验研究发现,与低碳水化合物饮食相比,高碳水化合物饮食在10至15周后饱腹感会显著增加。
此外,一项观察日常生活中个人随机消耗低碳水化合物和高碳水化合物饮食的研究也发现,通过一年的追踪,这两种饮食并没有持续的能量摄入差异[5],他们长期平均体重减轻几乎是相同的。因此餐后胰岛素分泌的个体差异并不能预测在每种饮食中谁的体重减轻最多。
尽管 CIM在最近的实验中存在争议,但这并不能否认胰岛素在调节体脂方面的重要作用。一些敲除了胰岛素分泌相关基因的小鼠或用药物抑制胰岛素分泌的人群体脂都会减少。糖尿病患者在确诊之前通常会发生体重下降,而在增加内源性胰岛素分泌或外源性胰岛素治疗后,患者往往会体重反弹。这些都证明了胰岛素在体脂调节中起着重要作用。而以上的一些实验虽然各有缺陷,比如小鼠的代谢与人类并不完全相同,人体试验时间则太过短暂等。但这些实验也不应该被忽略。高胰岛素不一定会直接导致体重增加,也不能靠其准确地预测未来的体重变化,直接用胰岛素分泌差异或胰岛素作用来解释是否会发生肥胖并不合适。我们更应该综合考虑胰岛素对不同器官的多效性作用,包括那些独立于碳水化合物摄入的因素之外的胰岛素功能,以此更好地理解胰岛素在肥胖中的作用,提高我们对肥胖的原因和治疗的理解。
一点老生常谈
目前现代医学尚未能给肥胖提供一劳永逸的治疗方法,但这并不意味着我们无计可施。短期的低碳水生酮饮食确实让很多人成功的减轻了体重,但长期使用低碳饮食也存在一定的弊端,比如导致头痛、便秘、肌肉痛性痉挛、腹泻以及酮症,少数人还会出现心血管突发疾病。
对于普通人来说,减肥除了能获得苗条体形之外,更重要的是获得健康。而合理的饮食和有规律的生活方式,加上适度的运动才是健康减肥的关键。
参考文献
[1] Ludwig DS, Aronne LJ, Astrup A, de Cabo R, Cantley LC, Friedman MI, Heymsfield SB, Johnson JD, King JC, Krauss RM, Lieberman DE, Taubes G, Volek JS, Westman EC, Willett WC, Yancy WS, Ebbeling CB. The carbohydrate-insulin model: a physiological perspective on the obesity pandemic. Am J Clin Nutr. 2021 Sep 13;114(6):1873–85.
[2] Speakman JR, Hall KD. Carbohydrates, insulin, and obesity. Science.2021;372(6542):577– S, Wang L, Togo J, Yang D, Xu Y, Wu Y, Douglas A, Speakman JR. The carbohydrate-insulin model does not explain the impact of varying dietary macronutrients on the body weight and adiposity of mice. Mol Metab. 2020 Feb;32:27-43.
[3] Hall KD, Guo J, Courville AB, Boring J, Brychta R, Chen KY, Darcey V, Forde CG, Gharib AM, Gallagher I, Howard R, Joseph PV, Milley L, Ouwerkerk R, Raisinger K, Rozga I, Schick A, Stagliano M, Torres S, Walter M, Walter P, Yang S, Chung ST. Effect of a plant-based, low-fat diet versus an animal-based, ketogenic diet on ad libitum energy intake. Nat Med. 2021 Feb;27(2):344-353.
[4] Shimy KJ, Feldman HA, Klein GL, Bielak L, Ebbeling CB, Ludwig DS. Effects of Dietary Carbohydrate Content on Circulating Metabolic Fuel Availability in the Postprandial State. J Endocr Soc. 2020 May 26;4(7):bvaa062.
[5] Guo J, Robinson JL, Gardner CD, Hall KD. Objective versus Self-Reported Energy Intake Changes During Low-Carbohydrate and Low-Fat Diets. Obesity (Silver Spring). 2019 Mar;27(3):420-426.
0
推荐




 京公网安备 11010502034662号
京公网安备 11010502034662号 