三年的新冠大流行,为我们系统观察免疫系统对抗病毒时的性别差异创造了难得的机会。
撰文 | Catherine Offord
编译 | XZ
全球新冠大流行到现在已持续近三年,在这场人类与病毒的战争中,男女之间对抗病毒的差异也逐渐清晰。早在2020年2月,也就是新冠大流行暴发的初期,研究人员就观察到,尽管男性和女性感染新冠病毒的人数相接近,但男性似乎更有可能死于这种疾病[1]。
随着新冠病毒病的病例不断增长,这种差异性的证据也不断显现。根据非洲人口与健康研究中心(APHRC)的数据显示[2],尽管世界各国对于新冠疫情的统计数据差异很大,但从整体来看,男性患者住院的可能性比女性患者高20%左右,并且一旦住院,男性更有可能需要重症监护,甚至可能死亡。
“性别不同导致免疫功能差异化”这个议题之前并不受人关注,但在过去几年里,这一观念已经在研究界占据了一席之地。例如,对2003年SARS和2013-2014年MERS暴发数据的分析表明[3, 4],男性患者的死亡风险高于女性。然而另一方面,自身免疫疾病如红斑狼疮、多发性硬化症和类风湿性关节炎等,则在女性中更为普遍。这些疾病被认为是由抗病毒免疫途径的过度激活引起的,因此,免疫激活也就像硬币一样存在两面性,有好也有坏。
二十多年来,霍普金斯大学彭博公共卫生学院的生物学家Sabra Klein一直在研究病毒感染的免疫反应,并表示新冠疫情正在帮助我们揭示传染病生物学中的一个重要事实,即,病毒和其他病原体对女性和男性的影响是不相同的,前者具有两条X染色体,而后者具有一条X染色体和一条Y染色体,这些差异的体现可能均需要从生物学角度来探索。
免疫反应中的性别差异
早期,研究人员在研究哺乳动物免疫系统时,发现雌性面对病毒感染时产生的免疫反应往往高于雄性,这种差异在先天免疫反应中尤为明显。
德国汉堡Heinrich Pette研究所的免疫学家Marcus Altfeld的团队长期专注于研究toll样受体7(TLR7)。这是一种能识别并结合病毒单链RNA的蛋白质,也是病毒入侵细胞的早期预警信号。早在2009年,当时还在哈佛医学院的Altfeld和他的同事们观察到[5],当面对少量艾滋病毒RNA的刺激时,女性中携带TLR7的浆细胞样树突状细胞(pDC)产生的干扰素明显多于男性;此外,与男性相比,女性中的中性粒细胞(具有吞噬作用)对I型干扰素(一种由免疫细胞释放的细胞因子)信号也更加敏感[6]。
不仅如此,近几年研究还发现,适应性免疫也存在这种差异。例如, Klein用流感疫苗实验研究小鼠对免疫刺激的反应[7],发现雌鼠往往产生更高的中和抗体反应。同时,也有多项研究[8]发现,女性(包括儿童和成人)的辅助性T细胞数量高于男性,这种细胞能够促进大量适应性免疫系统的激活。
Tips
先天免疫反应,是指机体对进入体内的抗原物质的一种无选择性的排斥、清除功能。
适应性免疫,又称特异性免疫,是一种经由与特定病原体接触后,产生能识别并针对特定病原体启动的免疫反应。
女性免疫反应更强,可能有助于对抗体内的病毒数量,例如在艾滋病毒感染后的头几年,女性的病毒载量往往比男性低得多。此外,接种流感、黄热病、登革热等其它病毒疫苗后,女性似乎比男性产生了更好的保护性抗体反应[9]。但是,从健康角度来看,事情还有另一面:这种过度活跃的免疫反应也可能使女性更容易患自身免疫性疾病。
面对新冠病毒时的免疫性别差异
在过去的一年中,许多医学研究报告称[10],男性比女性更有可能死于由新型冠状病毒引起的新冠病毒病。尽管各国的疾病统计数据有很大差异,但从生物学角度看,出现这种免疫差异似乎也是合理的。
下面就一起来看下,在面对新冠病毒感染时,男女之间的免疫差异性体现在哪里。
病毒入侵
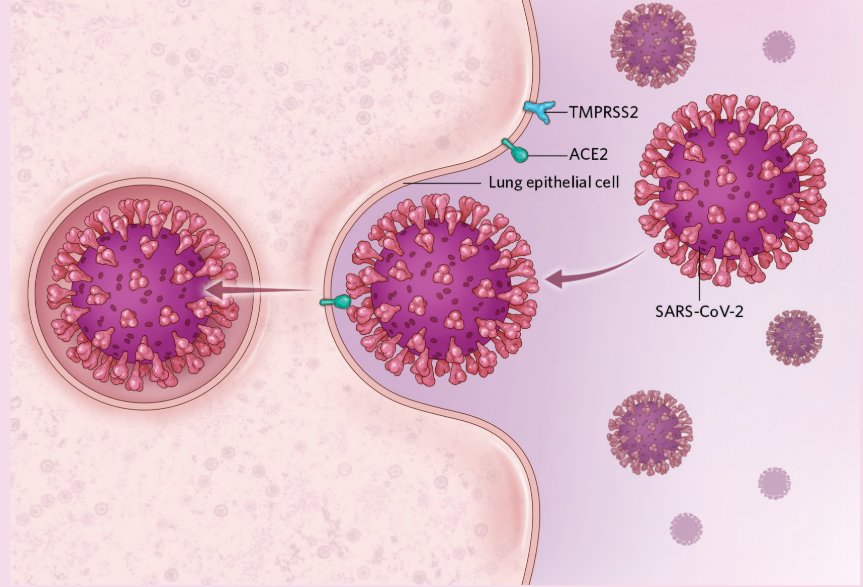
图源:Scott Leighton
新冠病毒通过与人体细胞膜蛋白ACE2和TMPRSS2结合,从而进入人体细胞。这两种膜蛋白在男女中的表达有所差异,其中ACE2的表达可能被雌激素下调,而TMPRSS2却能被雄激素上调,这种调控结果可能会导致男性存在更大的感染风险。
感染早期反应
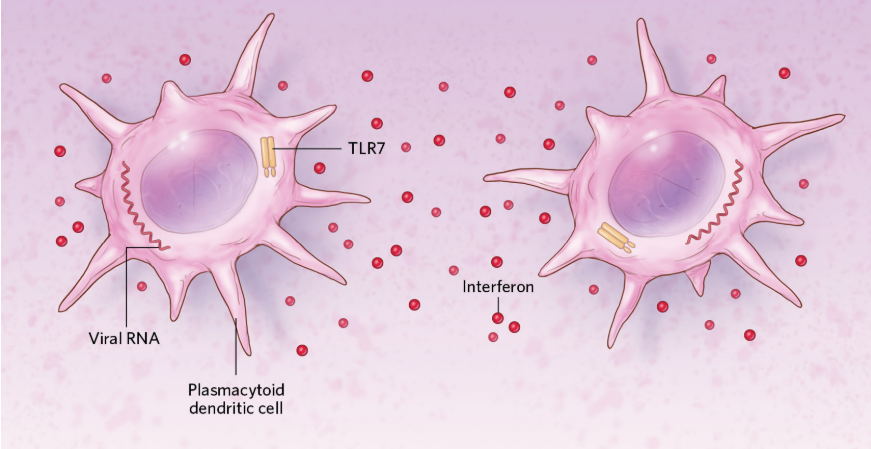
图源:Scott Leighton
病毒进入人体后被浆细胞样树突状细胞(pDC)吞噬,之后病毒的RNA被细胞中的蛋白质TLR7识别并结合,pDC细胞也随之被激活,分泌抗病毒因子(干扰素)。由于TLR7是由X染色体编码的,而女性有两条X染色体,故女性产生的免疫反应也更大;此外,女性的雌激素也可使pDC细胞等免疫细胞的活性增强。
先天免疫
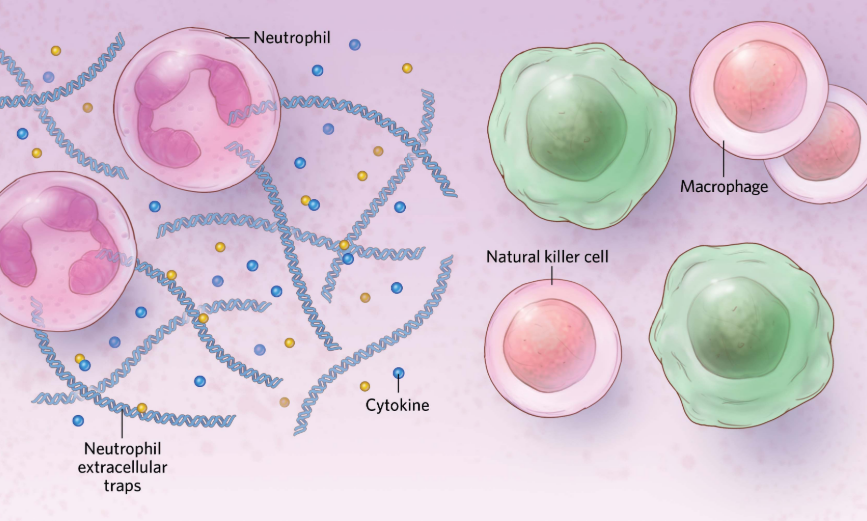
图源:Scott Leighton
在参与先天免疫的细胞中,如中性粒细胞,面对病毒感染时,女性比男性表现出更高的活性。这些细胞可以受到性激素的调节,与男性相比,女性的这些细胞可能具有更成熟的表型,能够更好地应对病毒感染。此外,其他免疫细胞,如自然杀伤细胞(NK细胞)和巨噬细胞,也显示出性别差异,这或许有助于解释女性中出现更强免疫反应的原因。
适应性免疫
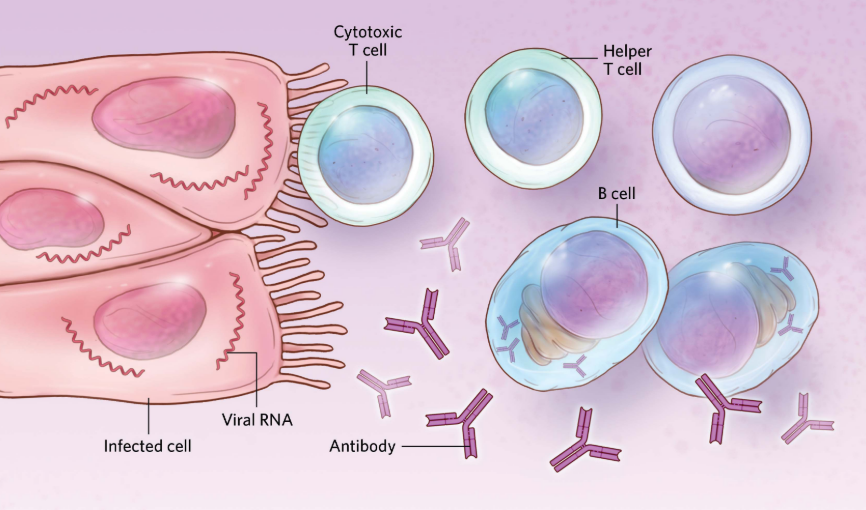
图源:Scott Leighton
病毒进入人体细胞之后,除了启动先天免疫之外,还会启动特异性免疫(适应性免疫)。此时,被感染的细胞会将病毒抗原呈递给T细胞和B细胞,引发T、B细胞免疫反应。其中T细胞会分化为TH细胞(辅助性T细胞,可辅助激活B细胞)和CTL细胞(细胞毒性杀伤T细胞,杀伤受感染的细胞),而B细胞在TH细胞的辅助作用下,也会分化成浆细胞,从而产生针对病毒抗原的抗体。有研究表明[11],在面对新冠病毒感染时,女性产生的抗体高于男性并且T细胞响应也更强。
免疫性别差异是怎样产生的?
近些年来,随着对免疫性别差异的研究深入,科学家渐渐地将这种差异归因于性激素浓度的变化,即,男性主要产生睾酮等雄性激素,女性主要产生雌激素和孕酮。
某些研究可以支持这一观点。有人发现[12],提前使用雌激素刺激细胞,可以降低细胞被艾滋病毒入侵的可能性。此外,与男性免疫细胞相比,女性中性粒细胞具有更成熟的表型,能更好地对干扰素刺激做出反应,并且使用雌二醇(最普遍的雌激素类型)来处理未成熟的中性粒细胞,可将其表型推向成熟[6]。进一步的证据则发现,女性绝经后患某些疾病的风险会发生变化[13],例如,绝经后妇女对流感疫苗的免疫反应弱于绝经前妇女。
类似的情况也发生在新冠病毒感染中。发表在medRxiv上的一项研究表明[14],在相同年龄段中,绝经后的女性比绝经前的女性更容易被新冠病毒感染,并且可能引发更严重的症状;同时,研究还指出,45岁以下服用含雌激素避孕药的女性比没有服用此类避孕药的女性其住院的可能性更低,这似乎意味着雌激素可能有助于女性免受病毒感染。
尽管激素可能起着重要作用,但男女之间最根本的差异还是性染色体不一样。女性有两条X染色体,一条X通常在发育早期被沉默或失活。但在2018年,图卢兹INSERM病理生理学中心主任Jean-Charles Guery及其同事的研究发现[15],位于X染色体上的TLR7基因在女性和患有克氏综合征(XXY)的人中以某种方式逃脱了失活,这使得女性表达TLR7蛋白的能力强于男性,也就意味着女性在面对病毒感染时有更强的免疫反应,但代价是患自身免疫行疾病的风险也更高。
为什么要研究免疫性别差异?
尽管新冠疫情推动了免疫性别差异的研究,但仍存在一些争议的地方。如预印本的一项研究表明[16],在新型冠状病毒感染中,抗体反应的性别差异可能没有其他流感病毒明显。对300多名轻症患者的血液测试表明,男性可能比女性产生更多的抗体来应对病毒。这一结论似乎又与先前描述的情况相反,这让一些研究人员开始怀疑自己的结论。
情况到底是怎样的?
事实上,免疫反应的差异并不只是受性别影响,年龄似乎也起到一定作用。美国国立卫生研究院(NIH)发起了一项研究[17],试图梳理年龄和性别等因素对新冠肺炎的影响,以及了解其他与性别有关的因素——如人的行为(吸烟、喝酒等)——和不同的健康状况是否也会引发不同的新冠感染症状。
诚然,每个人或多或少都会存在一些差异(不只是性别差异),在面对疾病或接受治疗时,所引发的反应也是有所不同的。当前,大多数人都在谈论个性化治疗,但迄今为止,没有一种个性化治疗在大多数传染病的治疗中取得进展,更不用说疫苗接种或其他预防策略了。
或许,将人群分为男性和女性,并优化治疗策略,才是个性化治疗的开端。因此,正确理解这些差异将是人类迈向精确医疗的关键一步。
参考文献
[1] Mobaraki, K., Ahmadzadeh, J. Current epidemiological status of Middle East respiratory syndrome coronavirus in the world from 1.1.2017 to 17.1.2018: a cross-sectional study. BMC Infect Dis 19, 351 (2019).
[2]
[3] J. Karlberg, D. S. Y. Chong, W. Y. Y. Lai, Do Men Have a Higher Case Fatality Rate of Severe Acute Respiratory Syndrome than Women Do?, American Journal of Epidemiology, Volume 159, Issue 3, 1 February 2004, Pages 229–231
[4] Alghamdi I, Hussain I, Almalki S, Alghamdi M, Alghamdi M, El-Sheemy M. The pattern of Middle East respiratory syndrome coronavirus in Saudi Arabia: a descriptive epidemiological analysis of data from the Saudi Ministry of Health. Int J Gen Med. 2014;7:417-423
[5]
[6]
[7] Lorenzo, M. E., Hodgson, A., Robinson, D. P., Kaplan, J. B., Pekosz, A., & Klein, S. L. (2011). Antibody responses and cross protection against lethal influenza A viruses differ between the sexes in C57BL/6 mice. Vaccine, 29(49), 9246–9255.
[8] 、[9] Aaby, P., Benn, C.S., Flanagan, K.L. et al. The non-specific and sex-differential effects of vaccines. Nat Rev Immunol 20, 464–470 (2020).
[10] Takahashi, T., Ellingson, M.K., Wong, P. et al. Sex differences in immune responses that underlie COVID-19 disease outcomes. Nature 588, 315–320 (2020).
[11] 11. Wenham, C., Smith, J. & Morgan, R. COVID-19: the gendered impacts of the outbreak. Lancet 395, 846–848 (2020).
[12] Rodriguez-Garcia, M., Biswas, N., Patel, M. V., Barr, F. D., Crist, S. G., Ochsenbauer, C., Fahey, J. V., & Wira, C. R. (2013). Estradiol reduces susceptibility of CD4+ T cells and macrophages to HIV-infection. PloS one, 8(4), e62069.
[13] Potluri, T., Fink, A.L., Sylvia, K.E. et al. Age-associated changes in the impact of sex steroids on influenza vaccine responses in males and females. npj Vaccines 4, 29 (2019).
[14]
[15]
[16]
[17]
本文经授权编译自the-,原标题为Sex Differences in Immune Responses to Viral Infection
0
推荐




 京公网安备 11010502034662号
京公网安备 11010502034662号 