男性与女性在生殖突变率存在差异,有明确证据表明男性更高,但是其本质原因我们并不清楚。而在体细胞突变率上,即使当前证据尚不明确,但用“男性拥有更高的体细胞突变率”会更容易解释许多疾病的发生现象。
撰文 | 刘昊轩
什么是突变?
作为生物的最主要的遗传物质,DNA在传递时偶尔会发生错误。这些错误有些发生在DNA复制时的错配,也有些是因为细胞内外环境的刺激而产生的碱基变化。这些发生在DNA上的错误统称为突变。
在人类中发生的突变通常被分为两类。发生在生殖系统并遗传给后代的突变叫生殖突变(Germline mutation),这类突变在物种遗传和演化中有重要的作用;而发生在身体其它组织并不会遗传给后代的突变叫体细胞突变(图一),此类突变与人类的健康息息相关。体细胞的突变可能会引起数千种疾病,其中大家熟知的癌症就是逐渐累计的体细胞突变引起的[1-3]。
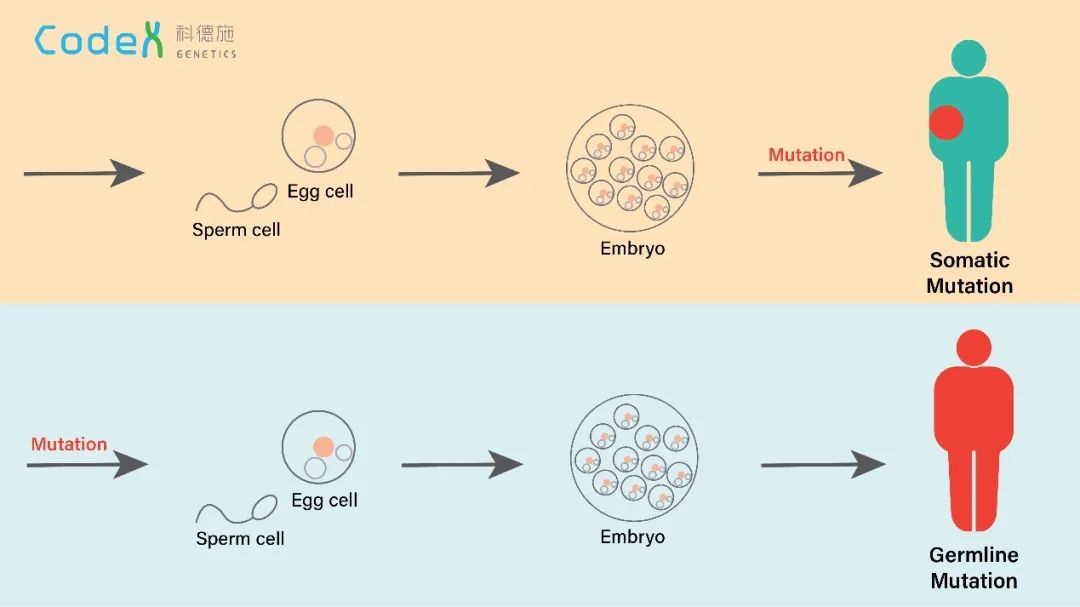
图一
生殖突变在两性之间的差异
突变率这一重要性状在男性和女性中可能存在很大差异。最早的证据来自于1946年,J. B. S. Haldane作为群体遗传学的创始人之一,在做血友病的谱系分析时,发现由于生殖突变引起的后代发病中,由于父系的新发突变导致的疾病概率远高于母系的新发突变导致的疾病[4],因此,至少拿X染色体来说,父系的生殖突变率高于母系。在1993年,李文雄的团队发现了序列层面的证据。他们的逻辑是:在人类中的三类染色体中(X染色体,Y染色体和常染色体),Y染色体是100%都存在于男性中,常染色有50%的概率存在于男性中,X染色体最少,只有33%在男性中。如果男性的生殖突变率高于女性的话,那以上三类染色体累计突变的速率应该是Y染色体 > 常染色体 > X染色体。他们发现这三类染色体上的中性区间(如基因间区和内含子区域)的DNA替换速率确实符合这个预测[5]。因为生殖突变是物种的演化的初始动力,该文章的作者将这个现象命名为 “男性推动的演化”(male-driven evolution)[6]。
近年来,随着基因组测序技术的发展,通过对亲本和子代进行全基因组测序,可以精确地鉴定出来自父系和母系的生殖突变数量。在人类中,父系的生殖突变频率大概是母系的三倍[7]。并且这个现象广泛地存在于除了鱼类以外的脊椎动物中(图二)[8]。
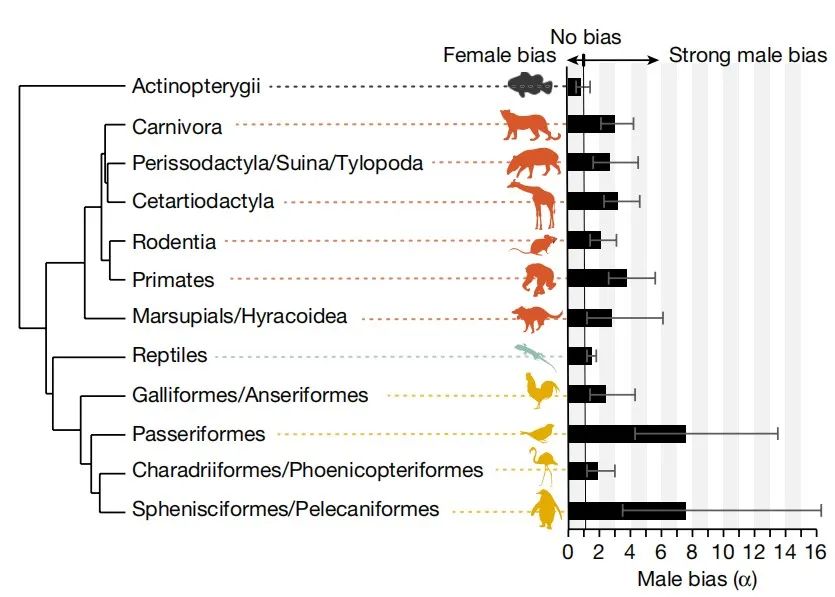
图二:脊椎动物各类群中雄性的生殖突变比值。左图的物种树是该研究所囊括的物种类群,右侧的柱状图为雄性/雌性的生殖突变比值,大于1说明雄性的突变更多。图片来自引文[8]。
体细胞突变在两性之间的差异
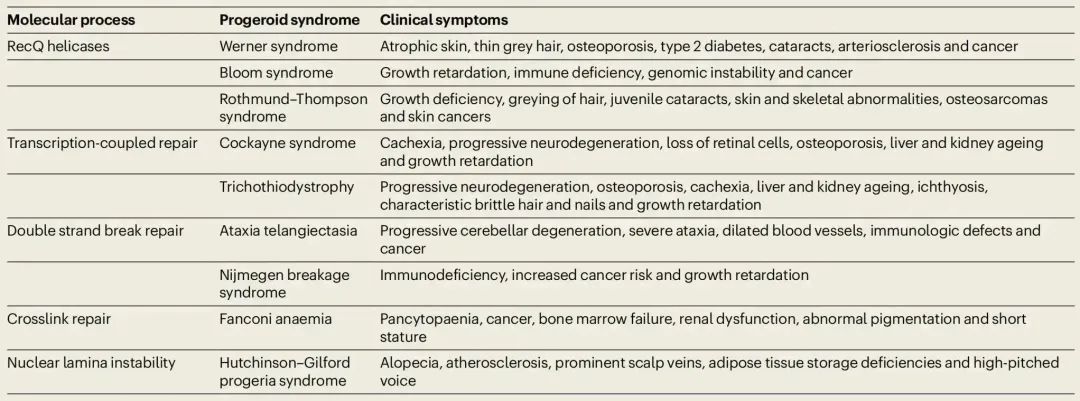
相比之下,体细胞突变的研究就相对少一些。因为体细胞突变是随着个体发育和细胞分裂逐渐累积的,所以每个体细胞都有一些独特的突变。因此研究体细胞突变常常需要进行单细胞基因组测序,而当前的单细胞测序精度还很难达到这个要求。不过有一些间接的方法可以用来推测体细胞的突变率,比如癌症是由体细胞突变的累积引起的,而多种癌症在男性中的发生概率更高,在一个对27种癌症进行分析的文章中,发现只有三种在女性中的发生概率高于男性,其余24种癌症均是男性的发生概率更高[9, 10]。并且在儿童中,也是男童的癌症发生概率高于女童,这个证据可以排除生活习性(吸烟、喝酒等)的影响,说明性别间的癌症发生概率差别是由于性别差异造成的直接影响[11, 12]。除了这个证据外,男性的衰老速度也高于女性,统计表明,女性的寿命显著地高于男性[13],尤其在百岁老人中,90%为女性,只有10%是男性[14]。虽然衰老是一个受多因素影响的进程,但是体细胞突变的累积在其中有重要的作用,主要依据是在人类和其它哺乳动物中,年龄跟体细胞突变的数量几乎呈完美的线性相关性(图三)[15],而且人类中,有极少数的个体会因为突变修复基因发生变异而产生高于常人的突变率,这些个体都会表现出早衰的性状(表一)[3]。
以上这些证据,虽然不能直接证明男性拥有更高的体细胞突变率,但却都可以用“男性拥有更高的体细胞突变率”来解释,这也正是近期提出的“有缺陷的雄性”假说[16]。生殖突变虽然多数是有害的,但是也有部分有益突变,这些突变也是推动物种演化的关键,所以在发现男性拥有更高的生殖突变率时,李文雄等人给它起了一个比较正面的名字——“雄性推动的演化”[6]。但是,基因组范围的体细胞突变率上升可以说是完全有害的,因此Hahn等人给这个假说起了一个负面的名字——“有缺陷的雄性”[16]。
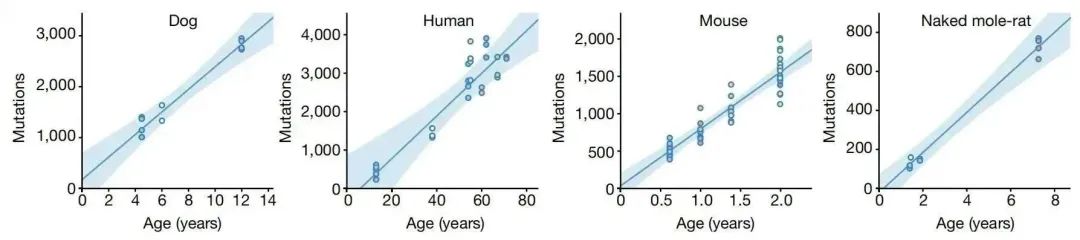
图三:四个哺乳动物中体细胞突变数量与年龄的相关性。横坐标为年龄,纵坐标为体细胞的突变数量。图片来自引文[15]。
表一:人类中由于DNA修复基因变异而引起的早衰疾病。数据来自引文[3]。
男性高突变率的机制——生殖突变
Haldane在1946年发现男性拥有高生殖突变率的时候,就提出了两种可能机制,这两种机制也是当前的主要解释方向和研究重点。第一种可能的机制是,由于卵原细胞的有丝分裂在胎儿阶段就已形成了整个初级卵母细胞池,而精子是在男性的一生中不断生成的,所以在同等年龄下,精子细胞所经历的分裂次数多于卵细胞。如果基因组中累积的突变多来自于复制时发生的错误,则分裂次数的差异可以解释性别间生殖系统突变数量的差异[17, 18]。第二种解释是,由于两性间生殖系统的生理特性及细胞机能的差异,导致男性的生殖细胞在保护和修复DNA的功能上不如女性[19]。但是,目前有一个实验证据与第一种解释的预测相反。因为精子分裂次数与卵子分裂次数的比值是随年龄上升而逐渐上升的,但是在人类中观察到的父本/母本的生殖突变比例并没有随年龄上升而上升,而是一直维持在3左右[20]。并且,有研究发现在男性中累计的生殖突变的突变谱与DNA损伤修复的突变谱类似,说明男性中的生殖突变不完全是DNA复制时的错误,至少有部分来源于DNA损伤修复[21]。因此,目前我们对于男性的高生殖突变频率还没有明确解释。
男性高突变率的机制——体细胞突变
尽管当前没有明确的证据表明男性的体细胞突变率更高,但是当前已知有一些机制可能会导致男性与女性之间的DNA修复机制上可能有差别。男性的细胞中有一条X染色体,而女性的细胞中有两条X染色体,为了保持两性之间X染色体基因表达量的平衡,在女性的细胞中,有一条X染色体会被包装成异染色体,导致基因的表达沉默,这个现象叫X-chromosome inactivation。但是,研究发现有15%的基因会躲过这个机制[22],所以这些基因表达量在女性中要高于男性,其中包括多个抑制癌症的基因,如KDM6A, ATRX, KDM5C, CNKSR2, DDX3X, MAGEC3等,虽然尚未发现这些会直接调控突变率,但是其它未被报道的基因可能会参与DNA修复等相关功能,导致女性有更低的突变率。另外一个可能的机制是,两性之间的性激素表达水平有很大差异,而一些性激素,尤其是类固醇类激素会调节DNA修复通路[23]。研究发现用于修复双键断裂的主要通路,非同源末端连接和同源重组,都受类固醇类激素的调节[24]。因此,这些修复通路的效率很可能在两性之间不同,进而导致突变率的差异。
总结
本文跟大家分享了男性与女性在生殖突变率和体细胞突变率上的差异。在生殖突变率上,有明确的证据表明男性更高,但是背后的机制还处于争论之中;而在体细胞突变率上,当前证据尚不明确,虽然有一些潜在机制,但具体影响尚不清楚,还需未来研究提供更多更直接的证据。
参考文献
[1] Poduri A, Evrony GD, Cai X, Walsh CA. Somatic mutation, genomic variation, and neurological disease. Science. 2013;341(6141):1237758.
[2] Martincorena I, Campbell PJ. Somatic mutation in cancer and normal cells. Science. 2015;349(6255):1483-9.
[3] Schumacher B, Pothof J, Vijg J, Hoeijmakers JHJ. The central role of DNA damage in the ageing process. Nature. 2021;592(7856):695-703.
[4] Haldane JB. The mutation rate of the gene for haemophilia, and its segregation ratios in males and females. Ann Eugen. 1947;13(4):262-71.
[5] Shimmin LC, Chang BH, Li WH. Male-driven evolution of DNA sequences. Nature. 1993;362(6422):745-7.
[6] Li WH, Yi S, Makova K. Male-driven evolution. Curr Opin Genet Dev. 2002;12(6):650-6.
[7] Kong A, Frigge ML, Masson G, Besenbacher S, Sulem P, Magnusson G, et al. Rate of de novo mutations and the importance of father's age to disease risk. Nature. 2012;488(7412):471-5.
[8] Bergeron LA, Besenbacher S, Zheng J, Li P, Bertelsen MF, Quintard B, et al. Evolution of the germline mutation rate across vertebrates. Nature. 2023;615(7951):285-91.
[9] Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021;71(3):209-49.
[10] Lopes-Ramos CM, Quackenbush J, DeMeo DL. Genome-Wide Sex and Gender Differences in Cancer. Front Oncol. 2020;10:597788.
[11] Liu Z, Yang Q, Cai N, Jin L, Zhang T, Chen X. Enigmatic Differences by Sex in Cancer Incidence: Evidence From Childhood Cancers. Am J Epidemiol. 2019;188(6):1130-5.
[12] Radkiewicz C, Bruchfeld JB, Weibull CE, Jeppesen ML, Frederiksen H, Lambe M, et al. Sex differences in lymphoma incidence and mortality by subtype: A population-based study. Am J Hematol. 2023;98(1):23-30.
[13] Bronikowski AM, Meisel RP, Biga PR, Walters JR, Mank JE, Larschan E, et al. Sex-specific aging in animals: Perspective and future directions. Aging Cell. 2022;21(2):e13542.
[14] Austad SN, Fischer KE. Sex Differences in Lifespan. Cell Metab. 2016;23(6):1022-33.
[15] Cagan A, Baez-Ortega A, Brzozowska N, Abascal F, Coorens THH, Sanders MA, et al. Somatic mutation rates scale with lifespan across mammals. Nature. 2022;604(7906):517-24.
[16] Hahn MW, Pena-Garcia Y, Wang RJ. The 'faulty male' hypothesis for sex-biased mutation and disease. Curr Biol. 2023;33(22):R1166-R72.
[17] Bartosch-Harlid A, Berlin S, Smith NG, Moller AP, Ellegren H. Life history and the male mutation bias. Evolution. 2003;57(10):2398-406.
[18] Campbell CD, Eichler EE. Properties and rates of germline mutations in humans. Trends Genet. 2013;29(10):575-84.
[19] Agarwal A, Aponte-Mellado A, Premkumar BJ, Shaman A, Gupta S. The effects of oxidative stress on female reproduction: a review. Reprod Biol Endocrinol. 2012;10:49.
[20] Jonsson H, Sulem P, Kehr B, Kristmundsdottir S, Zink F, Hjartarson E, et al. Parental influence on human germline de novo mutations in 1,548 trios from Iceland. Nature. 2017;549(7673):519-22.
[21] Gao Z, Moorjani P, Sasani TA, Pedersen BS, Quinlan AR, Jorde LB, et al. Overlooked roles of DNA damage and maternal age in generating human germline mutations. Proc Natl Acad Sci U S A. 2019;116(19):9491-500.
[22] Dunford A, Weinstock DM, Savova V, Schumacher SE, Cleary JP, Yoda A, et al. Tumor-suppressor genes that escape from X-inactivation contribute to cancer sex bias. Nature Genetics. 2017;49(1):10-6.
[23] Wengner AM, Scholz A, Haendler B. Targeting DNA Damage Response in Prostate and Breast Cancer. International Journal of Molecular Sciences. 2020;21(21):8273.
[24] Carusillo A, Mussolino C. DNA Damage: From Threat to Treatment. Cells. 2020;9(7).
本文经授权转载自微信公众号“ZJU生命演化研究”,原标题为《男性的DNA更容易比女性的出现错误吗?》。
0
推荐




 京公网安备 11010502034662号
京公网安备 11010502034662号 