1958年,DNA双螺旋结构发现者之一Francis Crick教授提出了著名的中心法则(central dogma)。这条法则指明了遗传信息从DNA传递至RNA,再由RNA传给蛋白质的单向不可逆过程,在此后的半个多世纪中成为分子生物学的核心理论。
现在,《科学》杂志的一项最新研究填补了中心法则的重要一环。这项研究将基因调控与mRNA、蛋白质水平定量联系起来,让我们以全局的视角看待这个关键的生命过程。

简单来说,中心法则包含了转录和翻译这两个核心过程。首先在转录过程中,DNA中储存的信息复制到信使RNA(mRNA)中;接下来的翻译过程中,根据mRNA的指令,核糖体将一个个氨基酸分子合成肽链,并完成蛋白质的组装。
整个过程的顺利进行,离不开细胞的调控。科学家希望了解的是,细胞是如何基于基因表达数据来调控转录和翻译过程,决定mRNA和蛋白质在什么条件下合成的?
这个问题的答案有着重要意义。例如,科学家可以根据这一调控机制实现精确的蛋白质水平操控,在合成生物学领域有着广阔前景。不过,以往的研究对这个问题的认识存在明显的不足。
这是因为在单个基因的层面,整个过程是单向线性的:从基因启动到生成mRNA再到合成蛋白质。因此,科学家通常会以线性思维来看待整个过程,在设计实验时改变的只是单个基因或少数几个特定基因,而没有彻底改变整个细胞系统。
根据这种思维,如果说基因表达的改变导致DNA转录出两倍的mRNA,那么合成的蛋白质也会加倍。但实际上,影响细胞调控的不仅有单个基因,还有整个细胞系统。将视角切换到系统层面,就会发现对中心法则的线性思维站不住脚。
细胞系统会加以全局的限制,尤其是限制了可用的RNA聚合酶和核糖体数量。例如,一个细胞中蛋白质的总浓度大致是恒定的。当细胞通过调控特定基因的表达来适应环境变化时,全局的限制使得发生改变的不仅有这些基因的表达,还有很多没有被直接调控的基因。
那么,基因层面与系统层面是如何共同影响细胞蛋白质组的?在最新研究中,来自加州大学圣迭戈分校(UCSD)的研究团队解决了这个被长期忽视的问题。他们从全局性限制的角度出发,定量分析了模式生物大肠杆菌的基因调控与mRNA、蛋白质水平的联系。
“我们投入大量时间与精力来定量研究这些动态过程,由此得以筛选出影响全局的小尺度变化。绝对的定量测定使得研究者能够将mRNA与蛋白质的水平定量联系起来。” 领导这项研究的UCSD教授Terry Hwa表示。
研究揭示了基因调控与mRNA、蛋白质水平的联系丨图片来源:Hwa Group/UC San Diego
为此,研究团队测定了大肠杆菌在不同生长条件下,超过1500个基因的启动子活性以及mRNA、蛋白质水平。这些数据使得研究者可以定量分析RNA聚合酶、核糖体活性与启动子活性和蛋白质浓度之间的相互影响。
在这个过程中,研究团队发现了意料之外的结论:决定蛋白质浓度的主要因素是启动子的活性;相比之下,细胞生长条件对合成的蛋白质浓度的影响要小得多。
最终,研究提出大肠杆菌的基因调控包含了两个主要原则。首先,蛋白质浓度主要由转录过程决定,而mRNA的翻译过程以及生长条件的影响较小。其次,转录与翻译过程是紧密协调的,这种协调性是通过大肠杆菌的一类反σ因子(抑制细菌开始转录的蛋白质)实现的,这个因子可以调节转录所需的RNA聚合酶在不同生长调节下的可用性。
这两项原则共同产生了细菌基因表达中心法则的定量公式,将mRNA和蛋白质浓度与相应启动子的调控联系起来。
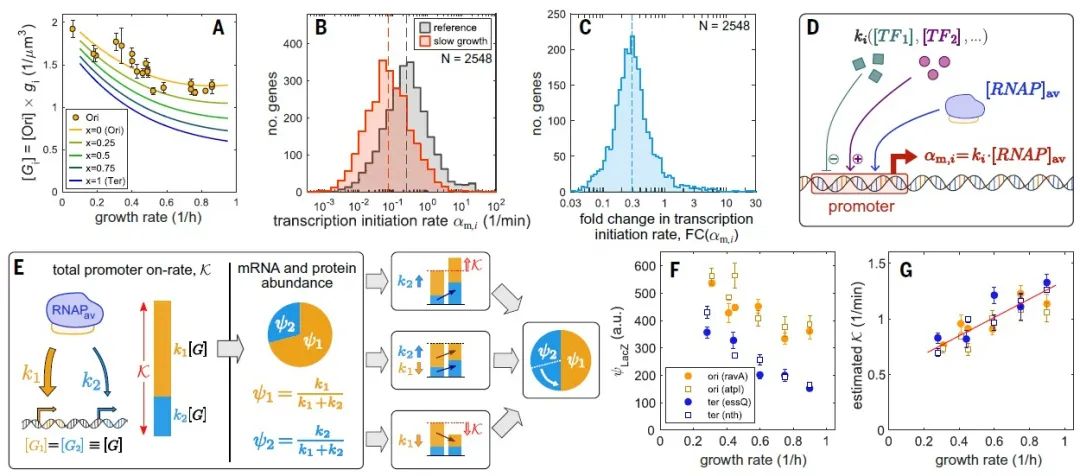
反σ因子在mRNA合成全局调控中的作用丨图片来源:参考资料[1]
Hwa教授相信,这项研究将重新书写课本中对基因表达和调控的描述:“我们一直使用的是错误的框架。这项研究提供了简单的公式,可以让我们理解细菌中的基因相互作用。这项发现可以用于更高效地设计基因回路,帮助解决更多生物技术和健康科学问题。”
参考资料
[1] Rohan Balakrishnan et al, Principles of gene regulation quantitatively connect DNA to RNA and proteins in bacteria, Science (2022). DOI: 10.1126/science.abk2066
[2] Rewriting the textbook on gene regulation: It’s the big picture that counts. Retrieved December 22, 2022 from
本文经授权转载自微信公众号“学术经纬”。
0
推荐




 京公网安备 11010502034662号
京公网安备 11010502034662号 