阅读:0
听报道
西方文化中的吸血鬼是人类既害怕又向往的一种造物:它可以吸食鲜血,永葆青春,长生不死。怀着对永生的渴望与向往,人类一直在追求长生不老的道路上探索。秦始皇派徐福出海,寻找传说中蓬莱仙岛的不死灵药;15世纪法国男爵吉尔斯·德·莱斯则疯狂迷恋炼金术,折磨、囚禁300多名男童,只为了在血里发现点金石。
撰文 | 王楠(清华大学生命科学学院博士研究生)
几百年过去了,人们对长生不老的追求依然没有停止。费尽心思搭配日常饮食,摄入胶原蛋白、保健药吃个不停,甚至植入干细胞……在美剧《硅谷》第四季中,亿万富翁Gavin Belson为了维持健康,定期从年轻的男孩身体中抽取血液输给自己。可以说,为了“永葆青春”,人们几乎尝试了所有的方法。

剧中的“换血”听起来有些吓人,但近年来的一些研究似乎为这种做法提供了一定的科学依据。有文章报道,年轻小鼠的血液真的可以使老年小鼠“重返青春”。不少公司已经开始为老年人或患有一定程度神经退行性疾病的人提供年轻人的血浆。斯坦福大学的Tony Wyss-Coray教授成立了Alkahest公司进行一些临床实验,希望能够研究年轻血液能否逆转人类的衰老。他多次出席各种会议、讲座,包括TED公开演讲,向公众介绍“换血逆转衰老(reverse aging)”的概念。
然而,不断输入年轻人的血液真的能实现长生不老么?这方面的研究有哪些实验证据呢?我们能通过这些实验得到什么启发呢?目前,实验研究的对象都是鼠,那给人类换血是否会有新的风险呢?

年轻血液真的能令小鼠“重返青春”
故事要从一个古老的实验开始说起。这个实验叫做异种共生(Parabiosis),它将两个有着不同特性、身处不同状态的动物连接到一起,让它们分享共同的血流,以此来研究血液中到底是哪种物质会影响健康。异种共生最早是在1864年由法国动物学家Paul Bert发展出的一种研究共享循环系统的模型:将两只小鼠的侧身切开,再将皮肤和肌肉壁缝合在一起,以此研究不同动物之间通过血液循环而产生的相互作用。
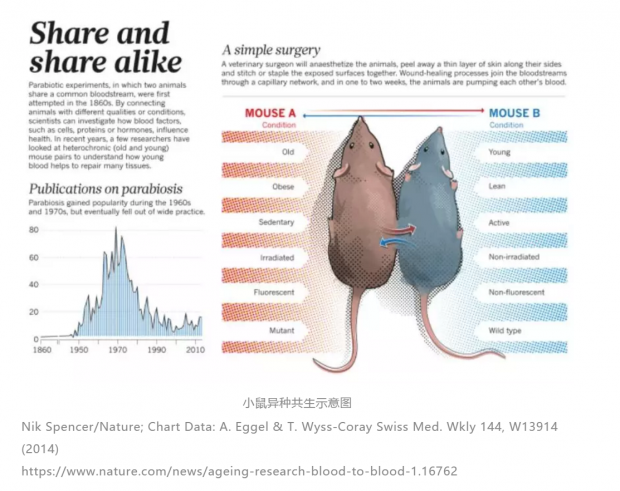
异种共生模型曾为瘦素(leptin)的发现提供重要的线索。美国杰克逊实验室的Douglas Coleman发现,有一种基因缺陷的肥胖小鼠与正常小鼠相连可以减少进食并迅速瘦下来。他猜测肥胖小鼠体内缺乏某种抑制肥胖的因子,所以才会不停地进食而导致异常肥胖;与正常小鼠连体后,正常小鼠体内的抑制肥胖因子抑制了肥胖小鼠进食,最后让肥胖小鼠瘦了下来。而后,洛克菲勒大学的Jeffery Friedman采用现代遗传学手段,经过八年的探索,根据这个缺失的特定基因找到其表达的蛋白,最终找到了抑制食欲的因子——瘦素。[1] 为此,Coleman与Friedman共同获得了2010年的拉斯克奖。
说到这里,你是不是有了什么好主意?
的确,科研界和公众都很激动,以为“瘦素”可以成为我们减肥的良药。然而很不幸,“瘦素”这个对动物模型有效的东西完全无法应用到人的身上。因为胖子的大脑无法感知到体内瘦素的含量水平,无法弄清身上有多少脂肪,也就不会下达“抑制食欲”的命令。所以那些保健品给胖子补充瘦素是没有用的,胖子不缺瘦素(脂肪含量越高瘦素分泌越多),缺的是对瘦素水平的感知。(详见《为什么胖子减肥这么难?》)所以瘦素是一个动物研究的结果完全不能在人身上实现的典型。
1956年,康奈尔大学的Clive McCay第一次用异种共生的动物去研究衰老。他发现,老幼共生的动物存活了9-18个月后,老年动物的骨骼重量和骨密度变得接近年幼动物。可是由于当时的实验方法存在一定问题,有些小鼠因免疫组织排斥或者饲养条件等原因出现死亡,因此这种方法之后也没有继续进行下去。
时间转到了新的世纪。斯坦福大学的Thomas Rando重新研究了异种共生的技术。他破坏了一些老年小鼠的肝脏和肌肉,并让它们分别与年轻小鼠和老年小鼠连接。结果发现,与年轻小鼠相连后,受伤老年小鼠的肝脏和肌肉的干细胞恢复到了更年轻的状态。这项研究部发表在2005年2月的Nature杂志[2]上,震惊了当时的医学界。
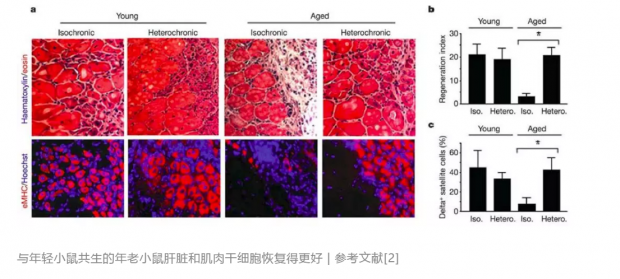
有一些文章报道,通过异种共生接触年轻的血液,老年动物的脊髓、大脑、肌肉和肝脏都变得更健康,换血还起到了抑制心脏肥大的作用[3-6]。然而,2016年,加州大学伯克利分校的Irina Conboy却发表研究,表明如果新老动物只是交换血液而不共享其他器官,得到的结果与异种共生是不同的——无论是在肌肉、肝脏还是大脑海马区,年轻的血液都起不到那么好的恢复效果了[7]。
2014年,斯坦福大学的Tony Wyss-Coray给老年小鼠注射了年轻小鼠的血浆后,发现它们脑内负责学习记忆的海马区出现了更多的神经连接,且它们的行为记忆能力也得到了提高。而且,年轻的血浆甚至不需要来自于同一物种,给老年小鼠注射年轻人类的血浆也能提升它们的认知和记忆。[8]
年轻血液可以使年老小鼠“重返青春”!这一实验结果固然令人兴奋、惊叹,但科学家们的任务还没有完成——接下来,他们需要深挖客观现象的本质,也就是寻找令年老的小鼠重返青春的具体因素。究竟是血液里的什么东西起了作用?又是怎样起作用的?是年轻血液里的新鲜细胞?是一些化学小分子?还是一些蛋白质?如果是蛋白质,那又是哪种蛋白?……就好像青蒿素的发现——古代中医采用青蒿治疗疟疾,那到底是青蒿里面的什么化学物质起了作用呢?屠呦呦经过不断尝试,发现青蒿的乙醚中性提取物能抑制鼠疟原虫,最终发现并提纯了青蒿素。面对一个现象,抽茧剥丝地找到是哪几种因子在起作用,这就是科学家所需要做的事。不同的是,血液比青蒿复杂得多,而衰老也比疟疾复杂得多。疟疾是由疟原虫导致的,人类早已知道;而衰老到底是怎样产生的,却没人说得清,所以想要找到衰老相关的因子,进而抵抗衰老,并不是一件容易的事情。
逆转衰老,还是促进衰老?
那么,抽丝剥茧,到底该如何下手呢?这就要提到科学研究的一种常用思维:“拆分” (fractionation)。它是用某种手段将一个混合物分成几种部分,再对各部分分别进行研究,再拆分,再研究,通过不断细化,最终提取出某种物质。从青蒿中提取青蒿素采用的就是拆分之法。要找到年轻血液中有“重返青春”功效的物质(因子),首先要缩小分析范围。血液由血浆和血细胞组成,血浆则主要由蛋白(蛋白是一种大分子结构)和小分子构成。科学家们发现,仅用血浆(不含血细胞)注射就能起作用,这说明可以使老年小鼠变年轻的物质不是年轻的血细胞。接着,科学家把血浆加热,令蛋白失活,再注射进老年小鼠体内,发现血浆不起作用了;于此同时,经过透析除去小分子的血浆却仍然有效,这说明我们要找的因子应该是某种蛋白而不是小分子。
下一步就要鉴定到底是哪些蛋白在起作用。科学家利用组学(Omics)方法对血液中可能与衰老有关的关键蛋白进行筛选,比如分析转录组和蛋白质组数据库,找出那些随着年龄增长表达量出现变化的蛋白,那么这些蛋白就有可能是“重返青春”的功臣。目前,科学家主要鉴定出了四种功能迥异的蛋白质分子:CCL11,GDF11,TIMP2和VCAM1。不过,关于它们的作用,还存在着许多争论。
CCL11
2011年,Tony Wyss-Coray发现,年轻小鼠与年老小鼠异种共生后,大脑的突触可塑性降低,空间学习和记忆能力受损。他们鉴定出一种蛋白——CCL11,把CCL11蛋白注射到普通的年轻小鼠体内,能够损害其记忆力并抑制神经元的生长。[4]
GDF11
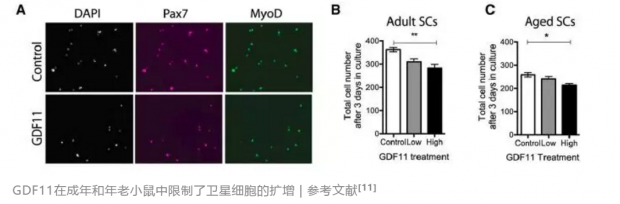
2014年,哈佛大学干细胞研究所研究员Amy Wagers和Richard Lee在Science背靠背发表了两篇文章。他们发现一种叫做GDF11(growth differentiation factor 11)的蛋白,在年轻小鼠体内含量丰富,随着年龄的增长,含量逐渐减少。通过实验,他们发现GDF11能模拟异种共生实验中的骨骼肌年轻化,也能促进脑内血管和神经的再生,改善小鼠肌肉、心脏和大脑的健康状况。[9,10]
不过,2015年,诺华生物医学研究所的David Glass对这一研究提出了质疑。Glass等人的实验结果显示了完全相反的结果:小鼠体内的GDF11随着年龄增长而增多,并且会阻止骨骼肌的再生。这说明GDF11不仅不能抗衰老,反而会加速衰老的过程[11]。近几年,天普大学(Temple University)的Steven Houser教授也多次发表文章质疑GDF11的抗衰老作用:他的实验证据表明GDF11不能解救衰老相关的心脏肥大,并且GDF11虽然减少了压力负荷过度诱导的心脏肥大,却导致了使小鼠极度消瘦的恶病质和早逝。[11]
TIMP2
2017年,Tony Wyss-Coray和同事们测量了不同年龄的人和小鼠中血浆蛋白的水平,并向小鼠体内依次注射了几种不同的蛋白,比较它们的作用。他们发现,一种蛋白可以改善小鼠的记忆,这就是金属蛋白酶2组织抑制剂(tissue inhibitor of metalloproteases2, 以下简称TIMP2)。TIMP2随着年龄增长而减少,如将脐带血中的TIMP2去除,脐带血就不能改善年老小鼠的记忆了。不过,这一蛋白对大脑和衰老的影响还需要进一步研究。[13]
VCAM1
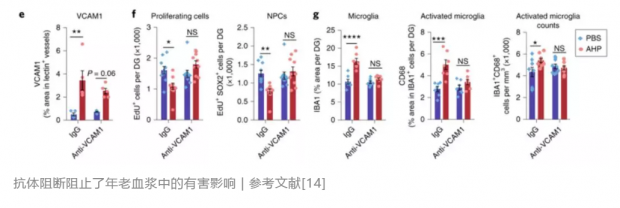
今年,Tony Wyss-Coray又通过转录组学和免疫组学分析鉴定出了一种新的存在于血脑屏障上的蛋白VCAM1。无论是人还是小鼠,年龄越大,大脑内皮细胞中的VCAM1表达越高。将老年小鼠或老年人的血浆注射给年轻小鼠后,小鼠大脑血管内皮细胞中的VCAM1表达会明显升高,同时小鼠的海马区新生神经元减少。令人欣喜的是,把大脑内皮细胞中的VCAM1基因敲除或者注射VCAM1的抗体阻断其功能,年老血液就不能再对年轻小鼠产生有害影响了。[14]
尽管实验证明年轻血液在细胞水平和一定的行为水平会对老年小鼠产生有益的影响,但我们还远远没有弄清楚“为什么”。是因为年轻血液稀释了有害的物质吗?起作用的因子到底是促衰老的还是促年轻的?异种共生带来的“年轻态”是不是以消耗生命力为代价,是不是一种“回光返照”?……目前的实验多是干细胞激活或行为学实验,并没有和寿命直接联系到一起。而且,目前发现的这几种蛋白的具体性质和作用在科学界还存在争议,需要不同课题组的科学家用不同的实验方法去验证。
以上这些蛋白——促衰老的或逆转衰老的——的研究是否可以直接用于开发抗衰老的疗法呢?是不是意味着人类长生有望了呢?接下来,我们再介绍一下现阶段有一定可行性的抗衰老疗法,以及将动物实验结果商业化过程中存在的困难。
现阶段抗衰老疗法的机遇与挑战
衰老是一个极其复杂的过程,包括了分子、细胞和器官等的累积损伤,这些损伤导致了有机体功能的丧失,更容易生病和死亡。抗衰老疗法的定义是:通过延缓某些生物过程来减少年龄相关的功能性衰退,延迟多种衰老相关疾病的发病。在短寿命的模型生物体中(如线虫、小鼠等),有众多调节衰老的基因、过程和途径,为药物研发提供了大量潜在目标。人们从模型生物体中已经确定了数百种调节衰老或长寿的基因,其中大多数可以归纳为常见的通路和过程,如胰岛素/胰岛素样信号、自噬、氧化磷酸化和TOR信号。也有证据显示,对于进化过程中的不同动物来说,延长生命的通路和途径往往是相似的。例如,已证明,中断胰岛素-IGF1通路,能延长酵母、蠕虫、苍蝇和小鼠的寿命,而IGF1R突变也与人类寿命有关。进化上延长生命的基因和途径往往是变化不大的,因此也是药物研发的重要目标。[15]
然而,人类并不是线虫或小鼠的简单放大。虽然短寿命的动物模型在衰老领域有了很大突破,但在人类身上,很多与模式生物同源的基因却并没有显示出与衰老和长寿相关——在模式动物上似乎可信的结果,照搬到人类身上,却行不通了。
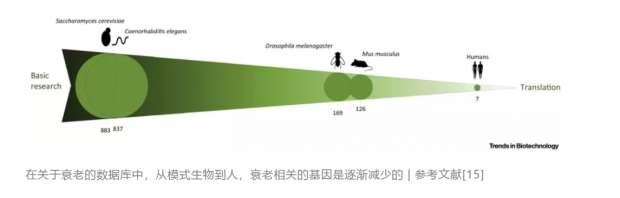
现有的抗衰老研究
过去20年,科学家先后提出多种抗衰老的方法和概念,其中最著名的5种包括免疫抑制剂雷帕霉素、葡萄皮化学成分白藜芦醇、端粒酶、热量限制、干细胞。
雷帕霉素
抗衰老药物研究的著名案例之一,就是用雷帕霉素(rapamycin)抑制TOR蛋白,能增加从酵母到哺乳动物的多种生物的寿命。但是雷帕霉素有很多毒副作用,制药公司和实验室们正在开发更安全的类似物。
白藜芦醇
雷帕霉素大家听说过的比较少,但白藜芦醇可是公众们很熟悉的保健明星。近年来,流传着一种说法:“喝白酒不健康,但喝葡萄酒有益健康,后者能保护心血管、抗癌、延缓衰老……(等等好处)”凭什么说葡萄酒有益健康?一个重要的理由就是,葡萄酒中含有一种神奇的抗氧化物质:白藜芦醇。David Sinclair在做博士后的时候发现了一个叫Sirtuin1的基因可以控制酵母的寿命。2003年,Sinclair发现白藜芦醇可以激活Sirtuin1基因,延长小鼠寿命。2006年,Sinclair发表文章称用含有白藜芦醇的饲料喂养高卡路里饮食的小鼠,结果发现吃白藜芦醇的鼠死亡率下降了31%——很多人据此认为白藜芦醇能抗衰老。
然而,后来的研究却很令人失望——来自瑞辉和安进两大制药公司的科学家发现白藜芦醇并不能激活Sirtuin1基因,之所以得到这样的结果是因为之前的实验有重大缺陷。其他许多证明白藜芦醇有作用的实验也都无法重复。好几个临床实验发现白藜芦醇对心脏疾病,代谢疾病,癌症,寿命延长等都没有作用,反倒引起了腹部不适或肾脏问题等种种不良反应。(详见《神药“白芦藜醇”,是怎么炒红的?》)
抗氧化物
抗氧化物(Antioxidant)在历史上一直是抗衰老领域研究的重点。一个关于衰老的理论是:有机体内的自由基过多产生强氧化作用,对蛋白质等生命分子造成损伤,损伤不断积累,最终导致衰老。这个理论一度非常流行,现在则受到了很大的挑战,并且流行病学的研究也不能支持抗氧化物对抗衰老有益的说法。
端粒酶
端粒(Telomeres)是染色体末端的一小段DNA-蛋白质复合物,在一些组织中随着衰老和细胞分裂而缩短。端粒酶(Telomerase)是细胞中负责延长端粒的一种酶。一项研究表明在成年小鼠中,过表达端粒酶能使寿命的中位数增加24%,而癌症的发生率并没有增加。然而其他实验室有结果声称端粒酶的过度表达可以引发小鼠患癌。所以激活端粒酶来抗衰老的想法需要验证,目前只有一个制药公司将其作为靶点开发药物,但是目前没有取得很大的进展。
端粒(Telomeres)是染色体末端的一小段DNA-蛋白质复合物,在一些组织中随着衰老和细胞分裂而缩短。端粒酶(Telomerase)是细胞中负责延长端粒的一种酶。一项研究表明在成年小鼠中,过表达端粒酶能使寿命的中位数增加24%,而癌症的发生率并没有增加。然而其他实验室有结果声称端粒酶的过度表达可以引发小鼠患癌。所以激活端粒酶来抗衰老的想法需要验证,目前只有BioViva和Sierra Science两家制药公司将其作为靶点开发药物,但是目前没有取得很大的进展。[15]
热量限制
热量限制(Caloric restriction )是目前最热的研究领域,也是最常见的提升健康和寿命的方法。不过,节食对于绝大多数人都太难了。轻断食,即每周中不连续的2天每天只摄取500千卡(女性)或600千卡(男性)能量的食物,其余5天自由饮食,不控制,可以是另一个约束更少的选择。然而有研究表明,热量限制对不同品系的小鼠有不同的影响,对一部分小鼠品系而言,寿命延长了,而另一部分小鼠品系的寿命却缩短了[16]。对于与小鼠千差万别的人类来说,热量限制的作用是不确定的。
干细胞
干细胞(Stem cell)疗法几年来炒得非常火,因为干细胞具有增殖和分化的潜能,一些公司便专注于研究干细胞,开发促进再生的药物。然而在全球范围内,干细胞移植疗法仍然处于临床试验阶段,人们仅证明了它对白血病、烧伤等个别疾病治疗有效,但其治疗阿尔兹海默病和抗衰老的效用则缺乏严谨的科学证据支持。[15]
商用挑战
以上这些抗衰老的研究成果都孕育着极大的商机。不过,要将这些成果真正转化为临床可用,还面临着极大的挑战。具体说来主要有以下几个方面:
01
衰老是个极其复杂的过程,目前人们还无法清楚理解衰老的生物学过程。尽管各类关于衰老的理论都有一批拥趸,但衰老的原因究竟是什么,科学界还没有达成共识。
02
细胞、动物和人类是三个不同的层面,同样的操作在三个层面的效果很可能不一样。在细胞实验中显示“有效”,并不意味着一定对人体有效。而且细胞和动物实验中所需要的“有效剂量”与人类摄入的剂量相差极大。
03
基因、节食、药物等干预手段可以操控一些短寿命模式生物的衰老进程,但不同的动物模型对同一手段的反应却差异很大。有些手段在某种动物身上效果很好,在另一种动物身上效果却很差。节食和药物干预结合可以使酵母的寿命提高10倍,但只能是小鼠的寿命提高30%-50%。从低等动物到高等动物,生命体复杂程度越高,干预手段的效果就越小。[17]在小鼠身上进行的衰老研究能否成功复制到人的身上也是很大的问题。在这样的现状之下,把目前动物试验所用的抗衰老方法直接挪用到人类身上是不可取的。
04
科学家开展研究衰老和寿命的临床实验,面临很多障碍。实际上,我们知道大量与衰老相关的潜在靶点和潜在干预措施,但是要验证它们的有效性,所需时间太长,所以最终只有其中一小部分可以用于临床。
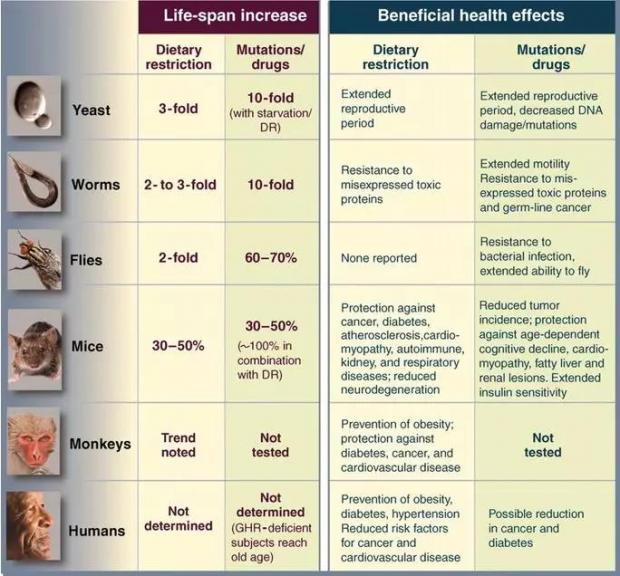
不同手段对不同模式生物寿命的影响 | 参考文献[17]
总的来说,目前没有一种靠谱的方法可以用来减缓人类的衰老。
换血是新希望?
年轻血液抗衰老是近些年来新兴起的研究课题,目前已取得的实验证据还有待重复和进一步验证。而从年轻血液中鉴别出的与衰老有关的蛋白,想要做成产品投放市场,也面临着上文提到的五种问题。
令人担忧的是,在种种问题都未解决,安全性有效性未经论证的情况下,一些公司已经迫不及待地将异种共生的实验结果应用到了人类身上。由于输血操作本身已经经过了长期的临床应用,安全性有足够的把握,不需要长时间的临床试验,也不需要FDA(美国食品和药物管理局)批准,所以一些公司开始向民众兜售“年轻血液”。其中以斯坦福大学的MD Jesse Karmazin和Craig Wright成立的Ambrosia公司最为出名。这家公司以试验为名,为35岁及以上的健康成年人输入年轻人(不到25岁)的血液。在Ambrosia的官网上可以直接购买血浆,一升年轻血浆定价约8000美元。Ambrosia宣传自己提供的年轻血浆可以解决包括阿尔兹海默病、帕金森病等一系列老年问题。
2019年2月19日, FDA发布了一项声明,提醒消费者警惕这种抗衰老输血。声明中这样说:
“几个州的企业正在提供年轻捐赠者的血浆输注,据称可以治疗各种疾病,从正常衰老和记忆丧失到严重疾病,如痴呆、帕金森病、多发性硬化症、阿尔茨海默病、心脏病或创伤后应激障碍。我们认为从年轻供体输注血浆以治愈,减轻,治疗或预防这些病症未经过FDA通常要求的严格测试,没有经临床证实,并且存在与使用任何血浆产品相关的风险。血浆给药的常见风险是过敏反应和输血相关的循环过载和较少的常见风险包括输血相关的急性肺损伤或输血相关的循环超负荷和传染病传播。简而言之,我们担心一些患者正在被不道德的人欺骗,他们声称年轻捐赠者的血浆可以用来治疗或作为治疗补救措施,收取数千美元的输液费用,把尚未得到证实,并且没有得到充分和良好对照试验证据的研究作为指导。这也可能阻止患有严重或难治性疾病的患者接受可能对他们有用的安全有效的治疗。”

2019年2月20日,Ambrosia Health公司在FDA发布警告后,停止了提供输入年轻血浆的服务。
除此之外,还有一些用在神经退行性疾病患者身上的小范围临床试验。比如斯坦福大学Tony Wyss-Coray成立的Alkahest公司,他们并不对参与者收费,只招募了18名志愿者,其中一名病人因为注射而起了疹子,另一名病人患上中风(与实验无关)。剩下的16名患中度或轻度阿尔兹海默症的患者在注射年轻血浆后,在认知测试中表现得并不理想。这个临床试验效果并不好,而且试验样本数量太少,不足以得出真正有效的结论。
除此之外,还有一些用在神经退行性疾病患者身上的小范围临床试验。比如斯坦福大学Tony Wyss-Coray成立的Alkahest公司,他们并不对参与者收费,只招募了18名志愿者,其中一名病人因为注射而起了疹子,另一名病人患上中风(与实验无关)。剩下的16名患中度或轻度阿尔兹海默症的患者在注射年轻血浆后,在认知测试中表现得并不理想。实际上,这个实验本身就有很大的问题:① 没有对照组,只是病人本身输血前后比较;② 自我评估的测试很主观;③ 而且试验样本数量太少,不足以得出真正有效的结论。这些患者在客观的认知测试中没有任何改善,实验结果不能支撑年轻血浆可以治疗老年痴呆等衰老相关疾病的依据。
抗衰老的研究任重道远,目前没有任何证据能表明输入年轻血浆可以延长动物或人的寿命,所以公众千万不要因为前文所述的异种共生和换血实验结果就觉得长生有望了。2014年Tony Wyss-Coray的小鼠换血实验发表后,一些博眼球的公众号就宣传“换血可以长生不老”,一些富豪就开始购买年轻人的血液给自己换血——这种简单粗暴的做法是极其愚蠢的。前文所述的FDA的警告中,已经强调了换血对寿命延长和神经退行性疾病都没有什么效果,而且还会有输血相关的风险。本篇文章正是在期待进一步研究、验证小鼠换血功效的同时,提醒公众谨慎对待输入年轻血液的做法。
面对各类科学研究成果,我们都应当以更客观的角度去看待。因为科学的发展是一个不断超越与扬弃的过程,许多研究结果是存在争议,需要经过反复验证的。一个结果不一定是错的,但是可能仅在一定条件下才会成立——而绝大多数人都不会去关注这个条件,只是关注这个结果。“这是某某教授说的”“这是某某大学做的科研成果”“这是某某杂志发表的”……不少人由迷信宗教走向了迷信科学权威。实际上,对于同一个课题,不同科学家的说法往往是不同的,甚至可能是完全相反的。今天的许多生物学理论都不过是假说(hypothesis),科学家们根据一个现象或一些发现进行合理的猜测,再不断用实验去验证、修正或推翻这个假说。想要把假说变成真正的理论,是一个极为漫长的过程,需要不断探索、去获取可靠实验数据的支撑。
以本文开头分享的2014年研究为例,年轻血液可以使年老小鼠“重返青春”,这个研究结果本身是很令人兴奋的,由此生发的科学问题也很值得科学家们进行探索,也许真的有一天,我们可以找到关键的致衰老或抗衰老因子。但在目前的阶段,无论是某些实验支持的CCL11,还是极富争议的GDF11,抑或是新发现的VCAM1,都还需要进一步研究才有可能应用到人类身上。科学家们需要设计许多不同的实验,去研究一个蛋白对小鼠衰老的影响:是否有副作用?除了细胞年轻化之外,对寿命是否有影响?能否通过临床实验用到人身上?……科学从发现到应用,是个极其漫长的过程。
说起长生不老,谁不希望如此呢?笔者在填报高考志愿时选择生物专业,不仅仅是因为生物研究的趣味性,也因为我幻想着通过生物手段延长自己的生命。这么多年过去了,完整地学习了生物知识,经历了严谨的科学训练,我已经习惯了更理性更谨慎地看待现在的科学研究,学会用批判性思维去分析每一个实验结果。科学家们确实正在努力地研究疾病、研究衰老,但我们要知道,学术论文发表的实验结果离真正的市场应用还有很遥远的距离。
小塞涅卡(Seneca the Younger)说:“内容充实的生命就是长久的生命。我们要以行为而不是以时间来衡量生命。” 孟子说:“夭寿不贰,修身以俟之。” 与其奢望长生不老,不如认真、诚敬地活好每一天。
参考文献
1. Coleman, D.L., A historical perspective on leptin. Nat Med, 2010. 16(10): p. 1097-9.
2.Conboy, I.M., et al., Rejuvenation of aged progenitor cells by exposure to a young systemic environment. Nature, 2005. 433(7027): p. 760-4.
3.Ruckh, J.M., et al., Rejuvenation of regeneration in the aging central nervous system. Cell Stem Cell, 2012. 10(1): p. 96-103.
4.Villeda, S.A., et al., The ageing systemic milieu negatively regulates neurogenesis and cognitive function. Nature, 2011. 477(7362): p. 90-4.
5.Brack, A.S., et al., Increased Wnt signaling during aging alters muscle stem cell fate and increases fibrosis. Science, 2007. 317(5839): p. 807-10.
6.Loffredo, F.S., et al., Growth differentiation factor 11 is a circulating factor that reverses age-related cardiac hypertrophy. Cell, 2013. 153(4): p. 828-39.
7. Rebo, J., et al., A single heterochronic blood exchange reveals rapid inhibition of multiple tissues by old blood. Nat Commun, 2016. 7: p. 13363.
8.Villeda, S.A., et al., Young blood reverses age-related impairments in cognitive function and synaptic plasticity in mice. Nat Med, 2014. 20(6): p. 659-63.
9.Katsimpardi, L., et al., Vascular and neurogenic rejuvenation of the aging mouse brain by young systemic factors. Science, 2014. 344(6184): p. 630-4.
10.Sinha, M., et al., Restoring systemic GDF11 levels reverses age-related dysfunction in mouse skeletal muscle. Science, 2014. 344(6184): p. 649-52.
11.Egerman, M.A., et al., GDF11 Increases with Age and Inhibits Skeletal Muscle Regeneration. Cell Metab, 2015. 22(1): p. 164-74.
12.Harper, S.C., et al., GDF11 Decreases Pressure Overload-Induced Hypertrophy, but Can Cause Severe Cachexia and Premature Death. Circ Res, 2018. 123(11): p. 1220-1231.
13.Castellano, J.M., et al., Human umbilical cord plasma proteins revitalize hippocampal function in aged mice. Nature, 2017. 544(7651): p. 488-492.
14.Yousef, H., et al., Aged blood impairs hippocampal neural precursor activity and activates microglia via brain endothelial cell VCAM1. Nat Med, 2019. 25(6): p. 988-1000.
Magalhaes, J.P., M. Stevens, and D. Thornton, The Business of Anti-Aging Science. Trends Biotechnol, 2017. 35(11): p. 1062-1073.
16. Liao, C.Y., et al., Genetic variation in the murine lifespan response to dietary restriction: from life extension to life shortening. Aging Cell, 2010. 9(1): p. 92-5.
17.Fontana, L., L. Partridge, and V.D. Longo, Extending healthy life span--from yeast to humans. Science, 2010. 328(5976): p. 321-6.
18. FDA statement
文章发布于2019年7月1日。
版权说明:欢迎个人转发,严禁任何形式的媒体未经授权转载和摘编。
话题:
0
推荐
财新博客版权声明:财新博客所发布文章及图片之版权属博主本人及/或相关权利人所有,未经博主及/或相关权利人单独授权,任何网站、平面媒体不得予以转载。财新网对相关媒体的网站信息内容转载授权并不包括财新博客的文章及图片。博客文章均为作者个人观点,不代表财新网的立场和观点。




 京公网安备 11010502034662号
京公网安备 11010502034662号 