阅读:0
听报道
编辑 | 韩若冰、琵思佛
编译 | 董唯元、刘航、于槐、刘天同
1 中微子、引力波和跷跷板机制
为什么宇宙中的普通物质比反物质多?为什么实验中只观测到左旋中微子,却不见右旋中微子?为什么理论上应该为零的中微子静质量实际却不为零?为什么这个不为零的静质量又如此离奇的微小?这一系列问题不仅直接挑战着标准模型理论,也深刻联系着宇宙暗物质等其他更多的未解之谜。
在目前所有理论中,有一个被称为跷跷板机制(Seesaw Mechanism)的理论,非常优雅地一举解决了上述所有问题。这一理论通过引入高能标粒子扩展了标准模型,并通过高能标粒子与左旋中微子的相互作用,使后者带上微弱的质量。
跷跷板机制又分为很多种,其中I型跷跷板理论最为简洁易懂,也最为流行。在I型跷跷板理论中的高能标粒子就是右旋中微子,也称惰性中微子。其背后的数学,简略而言,主要是一个2×2矩阵的两个特征值 ,其绝对值分别对应左旋中微子质量ML和右旋中微子质量MR,容易看出 ML·MR=a2,当MR越大,ML就会越小,如同跷跷板的两端,理论也就由此得名。
该理论虽然简洁优美,但对其进行实验验证则困难巨大。因为按照理论推算,右旋中微子的质量能标大约为109~1015eV,也就是说最小也相当于一个氢原子的质量,最大则相当于一个病毒的质量!尽管右旋中微子的质量远超所有重子(Baryon)和介子(Meson),但按分类仍属于轻子(Lepton)。若想使基本粒子间相互作用后,剩余的“残渣”仍然具有如此大的能量,以我们现有的技术肯定无法实现,其难度甚至超过了人工制造一个可以持续存在的黑洞。
最近,一个研究团队颇具创意地提出,可以通过宇宙中的引力波来探测右旋中微子的形成,从而验证I型跷跷板理论。这一研究成果在2020年1月28日发表于《物理评论快报》[1],作者包括美国研究者Jeff A. Dror,日本研究者Takashi Hiramatsu和Kazunori Kohri等。
论文在弦理论的框架中研究了几种宇宙弦的对称性破缺模式,发现这些自发过程与右旋中微子这类重型轻子的形成密切相关,并同时伴有频率特征明显的引力波辐射,其谱相与大质量天体融合时所辐射的引力波截然不同。依照这一推算,就像通过观察火焰颜色来推断燃烧物一样,我们可以通过探测宇宙中的引力波频率,来验证右旋中微子的形成。
如果右旋中微子的存在能够得到观测证实,也就是I型跷跷板理论得以证实的话,现有标准模型将得到强有力的扩展。尤其是其中弱相互作用和对称性破缺相关的理论,将得以极大补充和完善,继而解决一系列物理学家们探索已久的谜题。
例如“宇宙中为何普通物质多于反物质?”这一问题,目前唯一没有违背观测事实的理论解释,就是弱作用过程中CP破缺造成的正反物质衰变速度差异。然而现有的标准模型限制了这一理论,使之无法提供更为精确的计算结果,只能在非常宽泛的范围进行数量级估计。
又例如宇宙暗物质之谜,不仅超大质量的惰性中微子本身即为候选者之一,而且另外一个候选者轴子(Axion)是否存在,也与跷跷板机制密切相关。因为轴子在理论上的提出,是为了解决“强作用过程中CP意外守恒”问题,这部分也正是跷跷板机制如果被纳入标准模型就必然会影响到的理论。
[1] Dror J A, Hiramatsu T, Kohri K, et al. Testing the Seesaw Mechanism and Leptogenesis with Gravitational Waves[J]. Physical Review Letters, 2020, 124(4): 041804.
2 T细胞:我被癌细胞“缴械”了?
在免疫系统中,T细胞的激活是一个复杂而处于动态平衡中的过程。体细胞突变导致人体内每天都在产生异常细胞,而T细胞主导的免疫监控可以识别异常细胞的新抗原并及时将其清除,从而防止异常细胞进一步增殖形成肿瘤。
但在一些情况下,肿瘤细胞表面可以表达一种特殊的“暗器”——PD-L1蛋白。它可以识别并激活T细胞表面的受体PD-1,“缴械”T细胞,使其失活,进而导致肿瘤细胞逃出免疫系统的攻击[1]。该过程称为免疫逃逸(immune escape),是肿瘤细胞的“十大法宝[2]”之一(图1)。
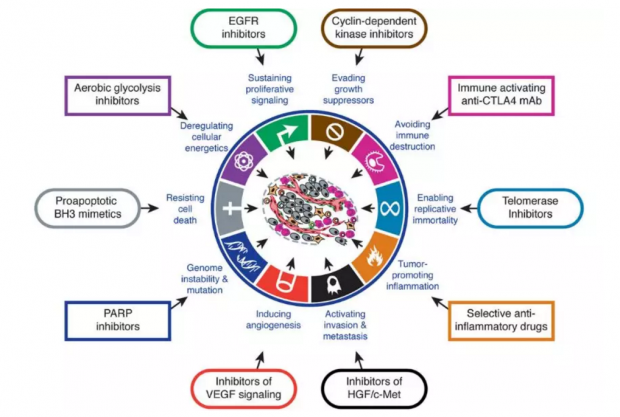
图1:恶性肿瘤的“十大法宝”及对应的治疗思路[2]——针对恶性肿瘤细胞区别于正常细胞的一些特点,人们设计了相应的治疗方向,已有相关药物获批治疗特定类型的肿瘤。从“免疫逃逸”这一特点上来讲,一些可以重新激活T细胞杀伤肿瘤细胞、以PD-1/PD-L1/CTLA4为靶点的的单克隆抗体已正式进入临床或正进行临床试验。
近年来兴起的一些免疫疗法,比如纳武单抗(nivolumab)和派姆单抗(pembrolizumab),正是利用癌细胞的这个特点,特异性抑制PD-1的激活,重新激活T细胞,从而利用患者自身的免疫系统清除肿瘤细胞。然而,由于T细胞激活的水平难以控制,有时患者的健康细胞也被激活的T细胞当成“靶子”而遭受攻击,导致自身免疫疾病的发生[3]。
以往的研究表明,T细胞表面的PD-1激活之后,需要与细胞内的SHP2蛋白结合,并激活其下游通路,从而导致T细胞失活。但这一过程具体以何种方式如何完成,人们并不清楚。
最近,一项发表在《科学进展》期刊上的结构生物学研究[4]描述了这一关键过程。德国弗莱堡大学和汉诺威莱布尼兹大学的研究人员发现,PD-1激活之后,其两个结构域ITIM和ITSM首先被磷酸化,并先后分别与SHP2的两个结构域C-SH2和N-SH2结合,共同形成一个结构域间界面 。其中N-SH2是SHP2激活的最关键因素,如果N-SH2发生突变,则SHP2完全无法被激活,而如果ITIM,ITSM和C-SH2发生突变,也会不同程度上影响SHP2的激活。在体外的T细胞培养实验中,通过控制磷酸化的多肽pY-ITIM和pY-ITSM加入的浓度和比例,实验人员观察到SHP2激活状态随之变化(图2)。
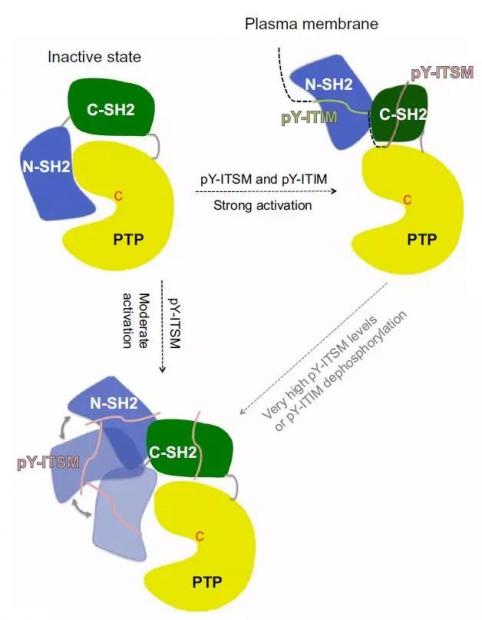
图2:结构域间界面SHP2蛋白的激活状态[4]——未激活的SHP2(左上)处于自抑制的状态,其N-SH2结构域占据磷酸酶PTP的活性位点。细胞膜上的PD-1被激活后,其两个结构域ITIM和ITSM均被磷酸化,并分别与细胞内SHP2的N-SH2和C-SH2结合,N-SH2取向稳定改变,导致SHP2自身构象变化,暴露PTP的活性位点,SHP2被激活(右上)。在另一种情况下,如果ITIM并未被磷酸化,或者ITSM的浓度较高,则ITSM就会“喧宾夺主”,同时与N-SH2和C-SH2结合,导致N-SH2取向的诸多变化,并对应SHP2不同的激活水平(左下)。
自此推论,如果以这个结构域间界面[5]为药物靶点,通过控制SHP2的激活,也许可以控制患者体内T细胞的激活水平,能够在清除肿瘤细胞的同时避免自体免疫疾病的发生,从而改善治疗效果。
[1] Mohme M, Riethdorf S, Pantel K. Circulating and disseminated tumour cells - mechanisms of immune surveillance and escape. Nat Rev Clin Oncol. 2017;14(3):155–167.
[2] Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell. 2011 Mar 4;144(5):646–674.
[3] Mulder WJM, Ochando J, Joosten LAB, Fayad ZA, Netea MG. Therapeutic targeting of trained immunity. Nat Rev Drug Discov. 2019;18(7):553–566.
[4] Marasco M, Berteotti A, Weyershaeuser J, Thorausch N, Sikorska J, Krausze J, et al. Molecular mechanism of SHP2 activation by PD-1 stimulation. Sci Adv. 2020 Jan;6(5):eaay4458.
[5] 注:结构域间界面,即inter-domain interface,暂无常用中文翻译,此处为直译。
3 悬浮的纳米颗粒如何冷却到量子基态?
科学家可以利用激光控制和操纵单个原子的量子特性,甚至能同时让数以亿计的原子冷却进入量子状态,从而产生物质的宏观量子态,如量子气体或玻色-爱因斯坦凝聚。近年来,这些快速发展在量子技术中得到了广泛应用。令人激动的下一步就是将量子控制技术应用到固态物体。最近,奥地利维也纳大学的科学家在《科学》杂志上发表了他们的实验结果—利用相干散射空腔冷却方法,使常温的玻璃珠具有宏观的低温量子行为[1, 2]。
固体的原子密度是冷原子系统的数十亿倍。同时固体中的原子束缚在一起随质心运动。那么,将原有的针对原子的制冷方法直接应用在固态颗粒上能否成功呢?要实现量子控制,就要把研究对象从周围环境的影响中隔离出来,尽可能去除热运动,将其冷却到接近绝对零度,使量子力学主导颗粒的运动。
奥地利的研究人员选择了一颗比普通沙粒还要小大约一千倍、内含有几亿原子的玻璃珠进行实验。隔离环境的方法是在高真空条件下将珠子捕获在一束高度聚焦的激光束中,这种方法最初是由诺贝尔奖得主Arthur Ashkin在几十年前提出的。文章的第一作者Uros Delic介绍说,真正的挑战是如何把珠子的运动冷却到量子基态。虽然借由原子跃迁的激光致冷技术是一种成熟的方法,但它并不适用于固体颗粒。
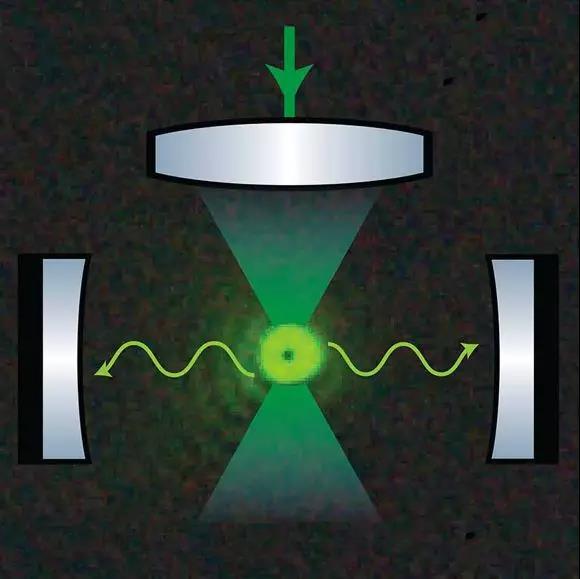
高度聚焦的激光场在两个高度反射的镜子(即光学腔)之间捕获一个纳米颗粒 | 图片来源:Aspelmeyer group, University of Vienna
研究小组改进了他们的激光冷却方法—“通过相干散射的空腔冷却”。该方法最初是由奥地利因斯布鲁克大学的物理学家Helmut Ritsch提出, 同时Vladan Vuletic和诺贝尔奖得主朱棣文也对此方法进行了独立的研究。
研究人员升级了实验,现在不仅可以去除更多的背景气体,同时还可以加入更多的光子来冷却。这样,玻璃珠的运动可以直接冷却到量子态。这个过程十分有趣:因为激光会加热材料中的电子,玻璃珠表面非常热,大约有300°C。但是珠子的质心运动却是超冷的,仅为绝对零度以上0.00001°C,可以证明热粒子的运动是量子化的。
固体的量子运动也被世界各地的其他小组研究过[3, 4],一般实验系统是由纳米和微机械谐振器组成的。维也纳大学助理教授、论文合著者Nikolai Kiesel表示,“光学悬浮带来了更多的可能: 通过改变光阱,我们可以用一种全新的方式操纵纳米颗粒的运动。” 物理学家也提出了一些更进一步的方案,例如结合所实现的运动基态,期望为传感性能、量子态下热机基本过程的研究,以及大质量粒子的量子现象的研究开辟新的机会。
[1]
[2] Delić U, Reisenbauer M, Dare K, et al. Cooling of a levitated nanoparticle to the motional quantum ground state[J]. Science, 2020.
[3]
[4] Vuletić V, Chu S. Laser cooling of atoms, ions, or molecules by coherent scattering[J]. Physical Review Letters, 2000, 84(17): 3787.
4 史上最全癌症基因组图谱
全基因组泛癌分析(PCAWG)是一个国际合作研究项目,研究者包括来自37个国家的1300多名科学家和临床医生。项目对属于38种不同肿瘤类型的2600多个基因组进行分析,创建了巨大的原发癌基因组资源库。多个研究团队基于此开展了癌症发展、病因和分类等方面的研究。
• 找到每种癌症的关键突变
该项目中的700多位研究人员开展合作,创建了首个可以比较不同种癌症、并找到共同基因突变的完整基因组图谱[1]。癌症类型既包括常见的结直肠癌、乳腺癌等,也涵盖了较罕见的胰腺癌和脑肿瘤等。
研究人员发现,任何特定肿瘤平均都存在四到五个关键突变,是它们驱动了癌症的发生。对于每种癌症类型,这些突变的差异可能很大。
该图谱为了解每种癌症类型中哪些基因和通路受损提供了基础,将有助于确定针对每种癌症类型需要进行何种基因检测,以填补潜在的检测缺口。
该研究也证明了相似的损伤可在不同组织中引起癌症,这意味着例如乳腺癌药物或许可以用于治疗食道癌。同时,通过识别各种癌症类型的损伤模式,该图谱可帮助研究者理解原发组织未知的癌症,以更有效地应用临床治疗方法。
研究者长期面临一个医疗难题:为什么对同种癌症的两名患者使用相同药物治疗,可能得到非常不同的结果。这项研究证明了,出现不同反应的原因都写在DNA之中。每个患者的癌症基因组都是独特的,但互相之间存在一定数量的重复模式,因此通过规模足够大的研究就可以识别所有这些模式,以优化诊断和治疗。
• 突变可能发生在确诊前的几十年
PCAWG 项目的另一个研究小组为包括胶质母细胞瘤、结直肠癌和卵巢腺癌在内的30多类癌症绘制了首个肿瘤发展时间表[2]。他们发现,肿瘤的发展可以跨越人的一生,引发癌症进展的突变可能在确诊的几十年前就出现了。
研究者称,绘制出正常衰老过程中产生的点突变,可以为人类基因组创建一个分子时钟,类似于追踪树木的年轮。这一标准能够用来估计癌症中某些突变出现的年龄,并衡量癌症的进程。
研究者观察到,肿瘤细胞内染色体计数的变化通常发生在癌症发展的后期。但在某些情况下,这些变化可能在确诊之前很多年就已经发生,例如多形性胶质母细胞瘤。
终末期癌细胞中多种变异并存,由此探究癌症的发展机制显得异常复杂。因此,了解导致癌症的突变序列和时间先后,有望帮助阐明这种机制。通过确定突变通常发生在癌症的早期还是晚期,还有望找到作为筛查依据的突变,以检测处于不同阶段的癌前细胞,最终帮助癌症的早期发现。
研究者称,全面了解疾病的分子进展是找到可以“早发现、早治疗”的靶点的第一步。许多基因突变在癌症确诊之前早已存在,这一发现为检出尚未完全恶变的异常细胞提供了可能。
[1] Campbell, P.J., Getz, G., Korbel, J.O. et al. Pan-cancer analysis of whole genomes. Nature 578, 82–93 (2020).
[2] Gerstung, M., Jolly, C., Leshchiner, I. et al. The evolutionary history of 2,658 cancers. Nature 578, 122–128 (2020).
5 量子纠缠与热化过程有何联系?
量子纠缠是量子力学中一种违反直觉的现象:在某一时间曾有过相互作用的粒子仍然彼此关联,即使两个粒子之间相隔好几光年,在一个粒子上进行测量也会影响另一个粒子的测量结果。这种效应被爱因斯坦称为“鬼魅般的超距作用”。
我们现在知道,量子纠缠不仅仅如同鬼魅,而且非常普遍。在我们生活的时代,量子纠缠效应开始得到实际应用,譬如用于加密和通信。
量子纠缠现象一直令人们着迷。最近,都柏林大学三一学院的理论物理学家发现了量子纠缠和热化现象之间的深刻联系[1, 2]。热化现象就是一个物体与周围环境相互作用,逐渐达到热平衡的过程,比如冬天里一杯热呼呼的咖啡逐渐冷却到和周围温度相同的过程。那么,量子纠缠与热化现象到底有什么联系呢?
在物理学中我们说热化过程是“不可逆的”,一杯咖啡不会先凉下来,然后魔术般地重新变得热乎乎。小到原子尺度,大到一杯咖啡,甚至宇宙自身的演化,不可逆性和热力学行为如何出现,一直是个吸引人的问题。在物理学中,我们用统计力学从微观角度理解这一过程。
在统计力学中,有几种不同的描述系统的方法,我们称之为系综,它们都可以用来描述系统如何达到热平衡。过去人们相信,对于足够大的系统,也就是粒子数大约为1023量级的系统,这些系综都是等价的。
然而,在这项新研究中物理学家发现,纠缠存在于热化过程当中,而且随着描述系统的方式不同,尽管可观测量的平均值与涨落没有区别,但纠缠结构却有很大不同。因此,这就为我们提供了一种方式来测试统计力学中的基础问题。这个想法对于一系列不同尺度的系统是普遍通用的,小到原子,大到黑洞,都可以实行。
[1] Brenes M, Pappalardi S, Goold J, et al. Multipartite entanglement structure in the Eigenstate Thermalization Hypothesis[J]. Physical Review Letters, 2020, 124(4): 040605.
[2]
6 油脂摄入过量影响细胞“垃圾回收”
人体细胞内每时每刻都在进行“大扫除”:细胞自有的再循环称为自噬,该过程将细胞产生的废物装进“垃圾袋”,转运至再循环区域,使降解后的物质重新变得可用。
德国马克斯·普朗克衰老生物学研究所的科学家在模式生物酵母菌中发现[1],作为“垃圾袋”的膜——自噬体,是在废物的周围即时形成的,而不是由已有的零件构建而成。
通过自噬进行的细胞自我更新是人体内的一项核心过程,对于衰老和许多年龄相关的疾病具有重要影响。大体上讲,再循环越丰富,人的寿命越长。领导研究小组的Martin Graef称,如果能够优化自噬机制,就有可能提升老年健康。
Graef小组中的博士生Maximilian Schütter详细观察了“垃圾袋”是如何制造的。自噬体由废物周围形成的磷脂膜构成,并转运废物使之进入再循环。此前,人们一直以为这些膜在细胞内业已存在,只不过是在废物周围进行组装。然而,新研究显示膜是即时形成的。自噬体的膜上存在一种蛋白质,能够激活游离脂肪酸,使之可被用来生成磷脂,磷脂进一步形成不断扩张的膜。
Graef称,这一发现至关重要,不仅改变了研究者对于自噬过程的认识,也开辟了新的研究道路。如果饮食中油脂过量,细胞内的再循环会随之恶化。他解释说,因为游离脂肪酸会被结合进入膜,所以改变饮食中的脂肪成分可能会对细胞自噬过程造成直接影响。
[1] (19)31331-5
话题:
0
推荐
财新博客版权声明:财新博客所发布文章及图片之版权属博主本人及/或相关权利人所有,未经博主及/或相关权利人单独授权,任何网站、平面媒体不得予以转载。财新网对相关媒体的网站信息内容转载授权并不包括财新博客的文章及图片。博客文章均为作者个人观点,不代表财新网的立场和观点。




 京公网安备 11010502034662号
京公网安备 11010502034662号 