阅读:0
听报道
撰文 | 余梁
审稿 | 陈梓豪
指导 | 闵小平(厦门大学)

今天给大家介绍的是由哈佛大学Stuart L. Schreiber教授在 Cell 上发表的文章”The Rise of Molecular Glues”。
2021年是发现环孢菌素A(cyclosporin A)和FK506以一种从未见过的方式发挥作用的30周年,即介导蛋白质-蛋白质结合的“分子胶水”。随着新型分子胶水探针和药物的大量涌现,人们对“分子胶水”这一领域的兴趣越来越浓厚。本文以奠基者的视角回顾了这个领域的发展轨迹。
01 背 景
早在人们知道环孢素A(cyclosporin A,CsA;sandimmune)是一种分子胶水之前,1971年瑞士制药公司Sandoz的一名生物学家和妻子在挪威度假时,发现了一份土壤样本。作为一项旨在发现含有抗真菌抗生素的微生物的筛选计划的一部分,员工通常会收集这些样本,但土壤含有的CsA的免疫抑制活性引起了Sandoz的注意。1979年,CsA被用于防止器官移植排斥反应,并于1983年被FDA批准。
与此同时在1983年,日本制药公司Fujisawa正开发一个项目,项目通过筛选新的生物活性微生物产品来寻找免疫抑制剂。在1987年,他们发现FK506(tacrolimus),这是一种新的由23个部分组成的大环内酯,它具有与CsA相似的活性,但更有效并且似乎在器官移植患者中得到更好的结果。
接下来的4年时间里,科学家竞相揭开CsA和FK506活动的分子机制,希望能创造出更好的类似物,最终孕育了分子胶水这一新领域。但分子胶水是怎么走到这一步的?在过去的30年里,分子胶水的前景如何?
02 分子胶水的发现
80年代中期,作者在耶鲁遇到了Bob Handschumacher,他给作者介绍了CsA靶向亲环素免疫抑制(CsA targeting cyclophilin for immunosuppression)。亲环素(cyclophilin)是一种小的(18kD)并具有一种奇特酶活性的蛋白质,它可以催化蛋白质中脯氨酸(prolyl)的顺式和反式旋转异构体的相互转化。事实证明,CsA抑制了这种“肽基-脯氨酸异构酶”的活性。但亲环素与免疫抑制之间没有显著联系。因为脯氨酸异构化非常容易发生,而且发生在毫秒到秒的时间范围内,所以从化学家的角度看,很难想象催化或抑制这一过程对细胞有什么意义。
那么,如何将这个看似无关紧要的功能与CsA对T细胞受体(T cell receptor,TCR)介导信号通路的抑制联系起来呢?
作者想知道是否还存在类似性质的化合物。Fujisawa制药公司(现称Astellas)通过寻找可以干扰TCR信号的天然产物发现了FK506。FK506不同寻常的结构——大环聚酮引起了作者的注意,他开始寻找相似结构的化合物。1980年Ayerst科学家在“Canadian Journal of Chemistry”上报道了一种不同但结构也是大环聚酮的雷帕霉素(rapamycin),它是一种抗真菌剂。作者猜测它和FK506同样具有CsA活性。
与Handschumacher的讨论让作者更加重视FK506和雷帕霉素靶点作用机制的发现。在1988年从耶路搬到哈佛后,作者利用亲和层析法(affinity chromatography)快速找到了FK506和雷帕霉素的靶点。虽然第一个靶标FKBP12与这两种化合物均有亚纳米摩尔相互作用(subnanomolar interactions),但其它靶标表现出差异结合(differential binding),而FKBP12与雷帕霉素表现出选择结合(selective binding)。值得注意的是,每一个FKBPs如同之前的亲环素一样,显示出对药物敏感的肽基-脯氨酰异构酶活性。亲环素和FKBPs被命名为免疫因子(immunophilins)。
FKBPs释放了一系列确定的活动,以利用化合物作为它们所调节的生物探针。免疫学的研究者们将细胞内信号传导描述为一个“黑匣子”,并注意到最强大的探针——细胞表面受体的抗体无法穿透细胞膜,而小分子却可以。作者与其他研究者在1990年有了一个惊奇的发现:结构相关的FK506和雷帕霉素破坏两个截然不同的通路。FK506干扰TCR信号,而雷帕霉素干扰IL2受体信号。更令人费解的是,亲环素-CsA复合物的行为类似于FK506复合物,尽管它没有与FKBP12结合。这一奇怪的结果提出了一个新的可能,那就是FKBP12-FK506和FKBP12-雷帕霉素复合物具有不同的特性,并且针对不同的通路。如果这是真的,那么简单地结合FKBP12将不足以实现这些变量应答,但竞争性结合可以阻止这些化合物作用。为了验证这一假设,作者设计了非天然大环506BD(FK506和雷帕霉素的FKBP12结合域),并实现了其多步合成。506BD能明显消除FK506和雷帕霉素的细胞活性(但不能消除不与FKBP12的CsA)。
作者将分子胶水的作用过程类比登月活动,认为KFBP12可能起到类似指令舱的作用,免疫抑制剂充当对接组件,但还没有找到登月舱。为了找到它,博士后Liu扩展了作者的亲和层析法研究,这次使用了亲环素-CsA、FKBP12-FK506和FKBP12-雷帕霉素作为诱饵。
Liu发现亲环素-CsA和FKBP12-FK506结合蛋白磷酸酶(protein phosphatase calcineurin),如图1所示。CsA和FK506被命名为分子胶水!这个术语在第二年被发表,启发了Schreiber等人对抗肽选择性粘合特定MHC和TCR蛋白作为免疫应答手段的类似工作。FKBP12-雷帕霉素的结合物则在1994年才被发现。
Mike Hall和George Levi的研究小组在酵母中发现FKBP12的隐性突变导致了雷帕霉素的耐药性,这为功能获得模型和雷帕霉素属于分子胶水的观点提供了有力支持。登月舱的证据来自于DRR(dominant rapamycin resistant)和TOR(target of rapamycin)耐药性等位基因区域的识别。
在与Crabtree利用CsA和FK506阐明钙-磷酸酶-NFAT的信号通路后,作者于1994年回到了雷帕霉素未完成的研究。Sabatini和Brown再次使用基于FKBP12-雷帕霉素亲和层析法纯化并表征的FKBP12-雷帕霉素靶标作为未知蛋白激酶mTOR,确认了雷帕霉素像CsA和FK506一样也是功能分子胶水。
20世纪80年代,细胞内信号传导、蛋白磷酸酶和蛋白激酶被认为是不可用药的靶点。由于发现现有的药物CsA通过抑制一种蛋白磷酸酶来阻断细胞内信号转导,因此前两种被认为是神话。3年后,随着mTOR抑制剂西罗莫司/雷帕霉素的批准,蛋白激酶将从不可用药名单中取消。2020年随着大环内酯WDB002的发现,科学家拓展了自然使用FKBP12作为指令模块和聚酮化合物的生物合成路径作为分子胶水来源的知识,FKBP12-WDB002可以结合CEP250几乎没有特征的盘状表面,如图1所示。不可用药的神话也被打破。
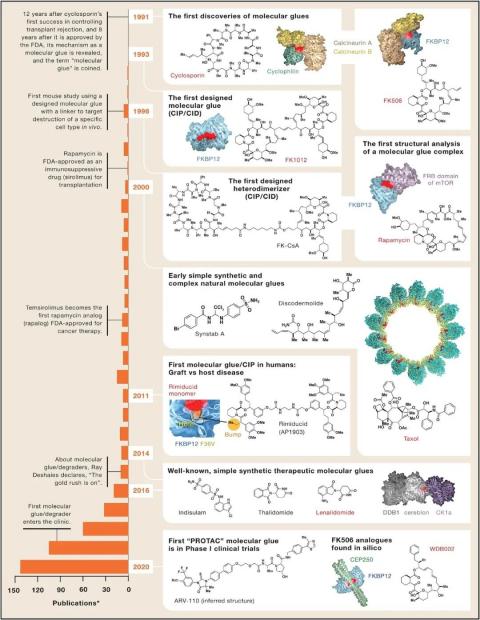
图1:分子胶水发现时间线
03 有目的分子胶水
20世纪90年代早期有了这种小而强大的分子胶水后,科学家开始回答有关邻近性在信号传导过程中的作用。蛋白质支架和小分子胶水的发现表明大自然利用邻近性普遍存在,如图2所示。作者受到Crabtree的启发,设计出了首个针对基因融合的“双功能“分子胶水,理论上它可以诱导任意两个蛋白质接近,这些蛋白可以遗传地附加到FKBP12或其他小分子结合模块上。化学邻近诱导剂(chemical inducer of proximity,CIP)由一步烯烃复分解反应结合两个FK506分子通过连接元素FK1012形成,如图2Bi所示。FK-CsA正是在这样的创新中发展起来,打开了使用任何不同基因融合的大门。
CIPs表明简单地诱导细胞内部分邻近足以引发一系列细胞后果的事件,如图2Bi和2Bii所示。Rimiducid是第一个用于人体测试的有人工目的合成的分子胶水,结果表明骨髓移植患者通过诱导其死亡受体融合靶的二聚化从而消除移植物抗宿主病,导致靶向细胞消融。利用分子胶水诱导邻近蛋白关联,基因表达和抑制、染色质甲基化和重构、细胞器和膜定位、蛋白质降解可以被轻微地控制。
04 非天然分子胶水
1996年,Deb Hung等人发现了天然产物圆皮海绵内酯(discodermolide),它可以稳固α和β微管蛋白单体的结合。这些化合物的作用并不是诱导新结合,而是稳定微管。然而,这些“分子钳”的潜在机制与化合物诱导新结合有关。2000年发现一种简单的合成化合物也可以诱导天然蛋白的结合,为这一领域开辟了新的方向。
到目前为止,我们所遇到的分子胶水只是以自然产物胶或其衍生物的形式迅速增长。它们以CIPs的形式连接在一起,混合搭配,但构建的基石总是天然的。小分子筛选发现synstab-A(合成稳定剂)的“现成”合成化合物促进了微管在体外和细胞中的形成。因此,即使是简单的非天然化合物也能诱导蛋白质结合。在这一发现后的数年时间里,针对天然蛋白分子胶水和分子钳的发现出现了爆炸式增长。
简单的小分子可以作为分子胶水,当你考虑到转录后修饰可以诱导蛋白质关联,就像一个错义突变安装一个不同的氨基酸可能完全改变蛋白质的样子和它的相互作用组。分子胶水只是这些天然模块的非共价延伸。
另一个催化步骤是由免疫调节药物(IMiDs)萨力多胺(thalidomide)和来那度胺(lenalidomide)以及抗癌药物indisulam的作用机制(MoA)研究转向合成分子胶水。这些小分子诱导E3连接酶和靶向蛋白的联系。更普遍的是,对含有或不含化合物的蛋白质靶标进行的细胞下拉实验显示,它们的靶标相互作用的变化频率高得惊人。合成化合物常常起分子胶的作用,远非自然选择的专属领域。
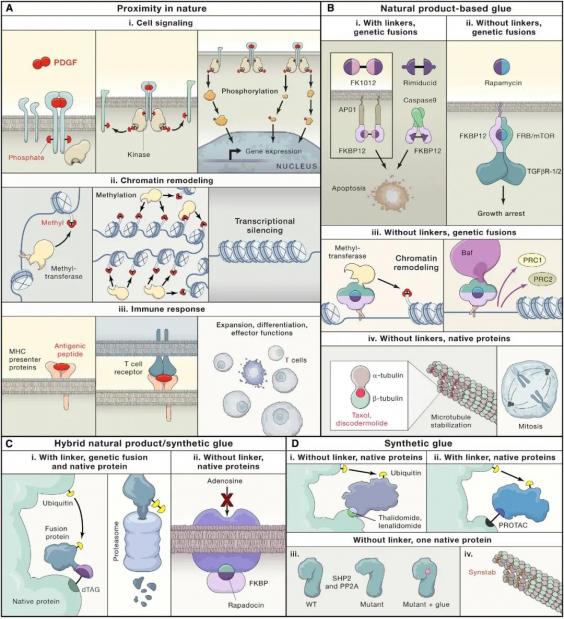
图2:分子胶水诱导蛋白质接近
05 意 义
与细胞质信号传导和核染色质信号传导等生物学信息传递手段类似,诱导蛋白的观念为药物开发带来了希望。当小分子与蛋白质结合时,它们通常改变它们的相互作用。假定在一个细胞中蛋白质有多个结合对象,小分子有能力改变蛋白质表面的布局,从而改变平衡,有利于不同蛋白质的结合。其结果包括增加(稳定剂)或减少(降解剂)靶标的寿命,改变其定位(矫正器),或激活信号,又或者基因表达。蛋白质和小分子间的相互作用使得药物治疗靶标范围更广,这些特征为分子胶水的前景奠定了基础。
我们已经知道分子胶水是有效的药物,它在治疗人类急性白血病中显示出控制小分子敏感等位基因的活性,并且是最引人注目的探针之一。利用分子胶水降解剂和PROTACs降解治疗靶标的新方法在新兴制药和生物技术公司中出现,药物发现过程正在被重塑。
06 未来
新型基因工具正在引导合成生物学家设想通过基因编辑技术等方式来重新布局细胞回路。而分子胶水可以让我们想象未来细胞电路可以在蛋白质水平上重新布局。除了使用分子胶水诱导新蛋白相互作用和调节药物靶标外,新型分子钳可以稳定蛋白动态结合。化学生物提供了一种手段可以发现分子胶水,它可以把蛋白质从复合物中取出来,并引导它们到新的化合物中去。这为干预和理解细胞回路提供了一种新的方式,并将其转化为全新的治疗方法。
参考资料
The Rise of Molecular Glues. Cell ( IF 38.637 ) Date : 2021-01-07 , Stuart L. Schreiber.
DOI: 10.1016/j.cell.2020.12.020
本文经授权转载自微信公众号“DrugAI”。
话题:
0
推荐
财新博客版权声明:财新博客所发布文章及图片之版权属博主本人及/或相关权利人所有,未经博主及/或相关权利人单独授权,任何网站、平面媒体不得予以转载。财新网对相关媒体的网站信息内容转载授权并不包括财新博客的文章及图片。博客文章均为作者个人观点,不代表财新网的立场和观点。




 京公网安备 11010502034662号
京公网安备 11010502034662号 