阅读:0
听报道
撰文 | 刘文豪
2021年10月4日,诺贝尔生理学或医学奖授予了发现温度觉和触觉受体的两位科学家David Julius和Ardem Patapoutian。在上一篇文章中,我们详述了触觉受体Piezo蛋白的发现经过和分子层面的研究过程。
伴随着分子水平研究的兴起,Piezo生理功能的研究亦如火如荼。人们发现,Piezo参与的机械感觉相关的生理过程远比想象的要广。从直观的触觉、本体感觉到生命最基础的细胞分裂、增殖,都有Piezo的身影[1]。而且,不仅限于哺乳动物,在鸟类[2]、斑马鱼[3]、果蝇[4-6]、植物[7-9]等其他物种中,Piezo均参与了机械力传导的生理过程。可见Piezo在进化上的功能保守性和重要性。今天我们将着重从哺乳动物Piezo的生理角色出发,介绍与之相关的生命活动过程。
合抱之木,生于毫末——Piezo1与血管功能
我们常用蓬勃有力之心脏,汩汩流淌之血液来形容生命力的旺盛。作为载体的血管,无时无刻不接受着血流的冲刷。血液对血管会造成两种类型的力学作用,一种是血流摩擦血管内皮的流体剪切力,一种是血流挤压血管壁造成的牵张力。
这些显而易见的力学过程自然被学者们与Piezo联系起来。2014年,英国利兹大学的David Beech与美国Scripps研究所的Ardem Patapoutian课题组均发现:基因敲除Piezo1,会造成胚胎鼠的死亡。胚胎鼠死亡的时间点是妊娠中期,这正是胚胎中血流出现的时间,由此,他们推断是Piezo1的缺失导致了血管发育的异常[10, 11]。
研究人员进一步找到了分子水平的解释:血流剪切力可打开机械门控Piezo1通道,使钙离子流入内皮细胞内;钙离子启动下游信号通路,解除内皮细胞的锚定,让它们可以随血流方向迁移、重排并逐步成熟。如此,就启动了血管的发育[10]。
此外,在成年鼠体内,血流剪切力打开血管内皮细胞的Piezo1使钙离子内流后,会释放一氧化氮,使血管舒张[12]。小动脉的平滑肌细胞上亦有Piezo1,血流造成的血管壁的牵张激活Piezo1后也会造成钙离子内流。继而,造成血管壁增厚,管腔缩小[13]。同时表达Piezo1和Piezo2的岩神经节和结神经结的末梢会投射到主动脉弓和颈动脉窦的血管壁上,形成血压感受器。在这些神经上同时敲除Piezo1和Piezo2后,会造成小鼠高血压和血压不稳定[14]。
血管遍布全身,盘根错节,一个成人的血管总长可绕地球赤道2.5圈——如此巨大而精密的生命机器,竟全起源于Piezo这样微小的蛋白质分子。恰如《道德经》所言:合抱之木,生于毫末。
非洲的卡西莫多——Piezo1与红细胞功能
力的作用是相互的。既然血管受到血液如此广泛的力学作用,那血液自身必然也受到机械力的影响。血液中含量最丰富的红细胞随血液流动时,不仅会遭受流体剪切力,还有血液渗透压变化带来的细胞膜张力改变,以及通过毛细血管时受到的挤压和摩擦。这些过程会和Piezo相关吗?
答案是肯定的。在2012年,学者们发现人类的遗传性干瘪红细胞增多症就与Piezo1基因突变有关。罹患该病的个体的红细胞形态干瘪、易破裂,并且有一定程度的溶血[15]。随后,研究者进一步在鼠的红细胞中发现了Piezo1的表达,并且确定了这一血液病的分子机制:基因突变造成Piezo1功能增强,通道开放的时间异常增加,钙离子内流增多,导致细胞膜上的钙激活的钾通道KCa3.1持续打开,细胞内的钾离子和水持续流出到细胞外,造成了红细胞干瘪[16]。
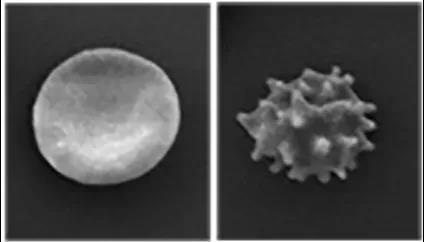
图1. 正常红细胞和干瘪红细胞(右)丨引自Ma, et al., 2018, Cell[9]
令人震惊的是,在非洲人群之中,竟然有多达1/3携带有此类突变!导致红细胞功能异常的突变为何能长久存在于基因组中?这让我们联想到镰刀形细胞贫血症:红细胞容易破裂,也许是为了阻止疟原虫在胞内持续生长,从而使个体能在疟疾区生存。事实也正是如此,2018年,Ardem实验室在鼠的红细胞Piezo1上引入这一突变,小鼠确实获得了对疟原虫的抵抗力[17]。
雨果曾说:“丑就在美的旁边,畸形靠近着优美,粗俗藏在高尚的背后。”
异常的红细胞就像《巴黎圣母院》中的卡西莫多,虽外形丑陋,却有一颗美好的内心,守护非洲人民免于疟疾之患。
而这颗心,正是Piezo。
破立之间——Piezo1与骨生成和修复
骨是一个高度动态的系统,它可以依据自身所受的力来调节质量和强度。例如,网球运动员惯用手的骨密度就高于非惯用手[18]。人若长期处于缺乏力负载的环境下——比如航天失重或长期卧床——骨密度和骨质量都会明显丢失,从而使骨折的风险更大。而骨量的变化和三种细胞密切相关,分别是位于骨表面能产生新骨的成骨细胞、深埋在成熟骨组织内的骨细胞、以及可吸收骨的破骨细胞[19]。
在骨组织感受力的过程中,是否也有Piezo的一席之地呢?
2019年,两个研究证实了Piezo1在此过程中的关键作用。成骨细胞的前体细胞可响应机械力产生电流,敲除Piezo1后,电流就会消失。在鼠的成骨细胞和骨细胞中特异性敲除Piezo1,鼠的骨形成、骨强度和骨结构都受到影响。并且,敲除Piezo1所导致的骨丢失无法通过增加骨的力负载来恢复。
更有意思的是,给野生型小鼠注射一种激动剂Yoda1,特异性地激活Piezo1,能让其长骨骨量显著增加。这提示我们或许可以将Piezo1作为分子靶点,治疗由航天活动或病理原因引发的骨丢失[20, 21]。
吐故纳新——Piezo与呼吸系统
自2019年12月开始,一种全新的冠状病毒肆虐全球。这种与17年前的SARS病毒同宗同源的病毒同样攻击人类肺部,危重症患者将面临严重的呼吸窘迫[22]。在我们呼吸的过程中,肺部持续受力,肺部呼吸感知和频率的调节自然与肺部的机械力受体密切相关,Piezo在这类感知过程中同样扮演了重要角色。
肺泡内皮细胞Piezo1的激活可保护肺泡-毛细血管屏障结构的完整性[23]。因此,将Piezo1作为药物靶点,有可能帮助重症病人避免呼吸机引起的肺损伤。
在神经嵴、节状神经节等感觉神经中表达的Piezo2对呼吸的调控至关重要。在这些神经中,Piezo2缺失或突变会造成新生儿呼吸窘迫,或是肺部扩张、呼吸的起始、呼吸节律等异常[1]。例如,分布在肺部的迷走神经可感知肺牵拉而兴奋,并调节呼吸节奏。但在这些神经中敲除了Piezo2之后,迷走神经感知肺牵拉的能力大幅受损,同时造成呼吸异常[24]。
呼吸是生命活动的典型特征,我们由此与外部气体世界交互,获得氧气,并排出二氧化碳。每一份呼吸,每一次吐纳之间,都是Piezo赠予我们的生命之礼。
触摸世界——Piezo2与躯体机械感觉
微风拂面,细雨沾肤,这是轻微的触觉;头悬梁,锥刺股,这是伤害性的机械痛觉;高空走钢丝,这是感知躯体平衡和四肢方位的本体感觉的极致体现。
这三类感觉是最直观的机械感觉,统称为躯体机械感觉。躯体机械感觉产生的第一步,是激活背根神经节(DRG)或颅感觉神经节的初级感觉神经。这些神经的一端穿入脊柱,并与下一级神经连接,传递信号到脑部,形成感觉。而神经的另一端则分布到外周感受器里,它们能直接感受到机械力刺激并产生神经信号,这就是躯体感觉的开始[25]。遍及我们全身的外周感受器就是我们日常触觉、痛觉和本体觉的基础。
以最大的器官——皮肤为例,背根神经节(DRG)的神经纤维分布到皮下,特化成各类机械感受器。轻触觉感受器需要响应较小的力,是低阈值机械感受器(LTMRs),主要有无毛皮肤(例如手掌)中的特殊细胞(默克细胞Merkel cells)和各类神经末梢小体(鲁菲尼末梢Ruffini ending、梅斯纳尔小体Meissner corpuscle和帕西尼小体Pacinian’s corpuscle)以及有毛皮肤(例如手背)中的特殊细胞(默克细胞Merkel cells)和环绕毛囊的各类纵向和环形针状的低阈值机械感受器。而痛觉感受器往往响应较大的伤害性机械刺激,是高阈值机械感受器(HTMRs)。在皮肤中,它们一般以自由神经末梢的方式存在[25, 26]。本体感觉的感受器最主要分布在肌肉组织中,主要包括肌梭和肌腱中的本体感觉感受器。它们能感受肌肉的牵张,继而反馈四肢方位和躯体平衡的信息[27]。
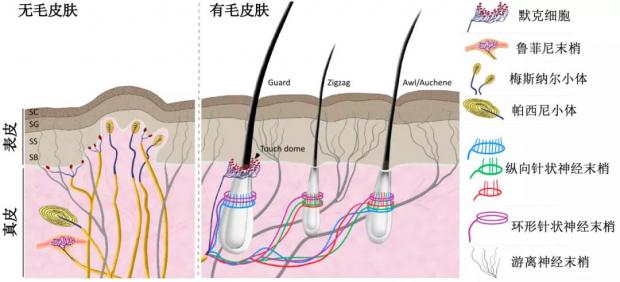
图2. 分布在皮肤的机械感受器丨改编自Abraira and Ginty, 2013, Neuron[25]
既然这些感受器能感知机械力,那么就会有一个核心问题:这些机械敏感细胞上表达的哪种蛋白可以感知机械力呢?也就是上一篇文章开头提出的、无数神经科学家长期追寻的目标。
学者们几经辗转寻找到的机械门控Piezo蛋白家族,会是那个答案吗?
Piezo2在这些感受器中的表达量就很高。事实上,在这些低阈值感受器或默克细胞中把Piezo2敲除之后,实验鼠出现了严重的轻触觉缺陷[28-30]。并且,Piezo2基因突变的人类也表现出轻触觉的缺陷和对纹理触感的障碍[31]。若将本体感觉感受器的Piezo2敲除,实验鼠则会出现严重的躯体平衡和四肢定位缺陷[32, 33]看来那个答案已然找到,Piezo2正是触觉和本体觉的受体蛋白!
然而Piezo2并不是完美的答案。从这些感受器敲除Piezo2并不影响机械痛的感知[29],甚至某些情况下使痛觉感知更敏感[34]。但稍令人欣慰的是,对于一类特殊的痛觉——触摸超敏痛和痛觉过敏(例如皮肤上出现创伤时,轻微的触碰都会引起剧烈疼痛),Piezo2是直接相关的蛋白[35, 36]。因此,那个直接负责痛觉感知的受体蛋白,仍然隐藏在迷雾中,仍让科研人员们“痛”并快乐着。
触觉感知赋予我们识别物体、区分纹理、感官运动反馈和社交的能力[25]。痛觉过敏警示我们需要保护脆弱的伤口,避免了二次伤害。Piezo2,见证着无数我们习以为常却至关重要的触、痛瞬间。
而关于本体感觉,则有一个古老的故事:数百万年前的那场体态革命,南方古猿抬头挺胸直立行走,从而解放了双手,人类自此开始了问鼎生物圈的征程。习惯双脚行走的过程也是场本体感觉的革命,而Piezo2,正是这场革命的亲历者。
一念成佛,一念成魔——Piezo相关疾病
前面我们介绍了Piezo通道在生理过程中扮演的重要角色:Piezo1作为血管内皮细胞流体剪切力感受器参与胚胎血管生成、成体血管形态调控;Piezo1和Piezo2共同作为动脉血压感受器调节血压;Piezo1作为红细胞膜上流体剪切力感受器调控红细胞体积;表达在成骨细胞和骨细胞上的Piezo1感知骨受力从而调节骨量;在肺泡中的Piezo1和肺部神经中的Piezo2分别参与保护肺泡屏障和调节呼吸节律;Piezo2表达在感知外周躯体机械觉的背根神经节(DRG)和颅神经节中,作为触觉、痛觉过敏和本体感觉的力感受器起始躯体机械觉的感知。
除此之外,Piezo还在干细胞命运决定[37, 38]、天然免疫[39]、上皮细胞稳态[40, 41]、脂肪细胞生长[42]、骨损伤修复时血管生成[43]、肠道功能维持[44-46]、维持心脏功能稳态[47]、排尿控制[48]、介导小鼠超声听觉[49]等等诸多力学生理过程中,作为机械力感受器,发挥着重要功能。生理功能相关成果的大量涌现,愈发凸显Piezo在哺乳动物整体生命活动中的重要地位。
功能如此重要,意味着一旦出现异常,后果也将很严重。前文所述的Piezo各类生理功能研究多是在实验鼠层面进行基因敲除,观察到严重的功能缺陷而确定的。现在,也已发现人群中的部分遗传病与Piezo基因的突变直接相关。
一类是功能缺失型突变。此类突变使Piezo功能减弱,导致机械敏感性变差,或离子通透能力减弱。在人群中,Piezo1的此类突变会造成先天性淋巴管发育不良(淋巴水肿)[50, 51];Piezo2基因的此类突变则会导致隐性远端关节挛曲综合症、脊柱侧凸、触觉和本体感觉缺陷、肌肉萎缩、新生儿呼吸窘迫[31, 52]等众多疾病。
另一类是获得功能型突变。这种突变使Piezo功能过强,通道的机械敏感性增强,持续开放时间延长而使阳离子持续内流,造成细胞功能紊乱。人类携带Piezo1的此类突变将会罹患遗传性干瘪红细胞增多症[53-55],Piezo2的此类突变则会导致显性远端关节挛曲(3型和5型)[56]。
异常的Piezo成为病魔之源,这提示Piezo能作为疾病治疗的药物靶点,有医药应用的前景。
至此,研究人员们从蛋白的发现,到分子水平的结构功能,到生理功能,再到病理过程等各方面对机械敏感Piezo蛋白家族有了较系统的了解。然而,在Piezo和机械感知领域的上空,依旧飘着几朵乌云:在分子水平,Piezo蛋白究竟是如何开放、失活和关闭的,还不得而知;部分Piezo1获得功能型突变所致的干瘪红细胞增多症病人同时也表现出功能缺陷型病人才有的淋巴管发育不良,反之亦然[57];人类中Piezo1功能缺失的个体并不会像鼠一样胚胎致死[1],这暗示了人类存在其他机械敏感蛋白可参与Piezo1相关生理过程;背根神经节(DRG)里敲除Piezo后依旧有机械敏感性[29, 58],这强烈提示了其他机械门控通道的存在;Piezo2参与介导痛觉过敏但并不直接介导机械痛[35, 36]。并且,在背根神经节(DRG)里敲除Piezo2之后痛觉感知反而更敏感[34],这说明介导机械痛觉的另有其人。
是乌云,也是机遇,我们仍大有可为。
科学家们在认识世界的时候,都会有改造世界的使命感。在Piezo领域,开发靶向Piezo的药物,将对基础科研和疾病治疗大有助益。基于Piezo的机械敏感性发展相关生物技术,或有可能实现机械力遗传学,为操纵特定细胞的基因表达创造了新的可能性。为了将Piezo推向应用,科学家做过哪些尝试呢?
原力与你同在——Piezo靶向药物
离子通道可以被特定的化合物激活或抑制,例如,辣椒素就能结合并打开TRPV1通道,这就是我们能感受到辣味的原因[59]。这些靶向离子通道的特定化合物可进一步用在基础科研和临床药物开发上。例如,辣椒素就已广泛应用于TRPV1结构功能的研究。学者们还利用TRPV1介导痛觉并在激活之后脱敏的特点,将辣椒碱用作镇痛药物[60]。
目前,在药物开发领域,离子通道是一大类药物靶点。Piezo参与了诸多重要的生理过程,并与多种疾病密切相关,自然也可作为重要的药物靶点[1]。另外,Piezo是全新的一类蛋白,若有通道特异的激动剂,对基础研究将大有裨益。
在这样的大背景下,Yoda1和Jedi分子应运而生。
因Piezo可以通透钙离子,研究人员在细胞内加入可指示钙离子的染料或荧光蛋白来指示通道的开放,而后利用荧光成像读板仪进行高通量的小分子筛查。Ardem实验室利用诺华公司的小分子库,在约325万个小分子化合物中鉴定到了Piezo1激动剂Yoda1[61]。而肖百龙课题组则幸运的在筛查了3000个小分子后即得到了可激活Piezo1的Jedi分子[62]。现在,Yoda1已广泛用于Piezo的门控机制和各类Piezo相关生物学过程的研究[63],而通过Jedi,研究人员提出了Piezo开放时的杠杆模型理论[62]。
Yoda和Jedi的命名皆出自《星球大战》,分别是尤达大师和绝地武士。“原力与你同在”是绝地武士们的信仰,也正契合了这两类小分子作为机械力敏感的Piezo通道的激动剂的理念。
但Yoda1和Jedi分子的药理学性质还略有不足:Yoda1是脂溶性分子,可溶度差[61],Jedi分子的亲和力较弱[62]。另外,目前用于抑制Piezo的化合物(钌红、Gd3+、GsMTx4)[1]都是较广谱的阳离子通道或机械通道的抑制剂,缺乏特异性。这都意味着我们仍需要找寻更有效更特异的Piezo靶向分子。

图9. Piezo1的两类激动剂——Yoda和Jedi丨来自网络,有修改
未来的曙光——Piezo在生物技术应用上的尝试
操纵特定细胞的基因表达,是生物学家们长久以来的梦想。光遗传学的出现[64],使得科学家们可以使用激光照射特定神经元来控制其基因表达,大大加速了解析各类神经元功能的进程[65]。但传统光遗传学受限于组织的透光能力,无法用于较深层的组织细胞。因此神经科学家们把目光投向了磁场、超声等具有穿透能力的物理刺激。利用这些物理信息操纵基因表达的核心前提,就是找到能感知此类信号的受体蛋白。
作为哺乳动物中首个被发现的、介导阳离子内流的机械敏感通道,Piezo家族立刻吸引了科学家的目光。2018年,研究人员成功将Piezo1用于超声控制的CAR-T细胞的基因表达[66]。
CAR-T细胞技术是近年来肿瘤免疫中炙手可热的领域。它通过在T细胞中表达特定的、可以识别肿瘤细胞的受体,来实现肿瘤细胞的精确杀伤。然而,这项技术可能存在脱靶效应,会损伤机体的正常组织,甚至危及病人的生命。并且,如何实现CAR-T细胞在特定组织的激活也是难题。为解决这些难题,研究人员把Piezo1表达在了CAR-T细胞上,利用超声引发钙离子内流(还有待严格证明的是:超声是否直接激活了Piezo1,引发钙离子内流)。钙离子的下游可激活转录因子,从而启动CAR受体表达。这样就成功实现了超声控制T细胞基因表达!利用该技术,研究人员只需在特定组织给予超声,就能在局部激活T细胞,精确杀伤肿瘤[66]!
癌症是当下人类面临的最大的健康挑战。Piezo的出现,或为人类对抗癌症之路投下一缕曙光。这缕曙光,也可伴随Piezo的机械敏感性,进入到各种领域中。例如用超声控制神经元,Piezo和光敏蛋白联用等等……这缕曙光也照出了生物技术未来的一个方向。
到这里,Piezo蛋白的故事暂时落下了帷幕。我们分上下两篇,从分子水平的机械敏感通道的存在,Piezo通道的鉴定,Piezo高分辨率三维结构的解析,Piezo感知机械力的方式;到生理水平Piezo参与血管生成和调控,红细胞体积调控,骨量调节,保护呼吸系统并调节呼吸,介导躯体机械感觉,以及Piezo相关疾病;再到应用上,Piezo靶向药物的寻找和Piezo在生物技术上的应用这三个层级讲述了Piezo蛋白的“封神之路”。
Piezo蛋白独特的分子组成、结构以及它在机械传导生理现象中的重要作用,使其当之无愧成为离子通道和机械感觉领域的明星蛋白。但Piezo蛋白的结构功能和生理功能的工作仍有诸多盲点,并且哺乳动物中还有其他机械敏感蛋白的存在(例如近来鉴定到的TMEM63[67])。这些都说明机械感觉这栋大厦还需大量添砖加瓦。
或许是冥冥之中的注定,在鉴定到Piezo通道2010年,那年的苹果公司发布会上,乔布斯在iPhone4上展示了惊艳世界的感知方位的陀螺仪。但我们不要忘了自身早在数十亿年前的起源之初,就装配了性能上强大得多的躯体位置感知系统。躯体感觉以及我们身体内许许多多的机械感知现象,都是Piezo带来的生命奇迹。
参考文献
1. Xiao,B. Levering Mechanically Activated Piezo Channels for Potential PharmacologicalIntervention. Annual review ofpharmacology and toxicology 60,195-218 (2020).
2. Schneider,E.R. et al. Molecular basis of tactile specialization in the duck bill. Proc Natl Acad Sci U S A 114, 13036-13041 (2017).
3. Faucherre,A., Nargeot, J., Mangoni, M.E. & Jopling, C. piezo2b regulates vertebratelight touch response. J Neurosci 33, 17089-17094 (2013).
4. Kim,S.E., Coste, B., Chadha, A., Cook, B. & Patapoutian, A. The role ofDrosophila Piezo in mechanical nociception. Nature483, 209-212 (2012).
5. Song,Y. et al. The Mechanosensitive Ion Channel Piezo Inhibits Axon Regeneration. Neuron 102, 373-389 e376 (2019).
6. Wang,P., Jia, Y., Liu, T., Jan, Y.N. & Zhang, W. Visceral Mechano-sensingNeurons Control Drosophila Feeding by Using Piezo as a Sensor. Neuron (2020).
7. Zhang,Z. et al. Genetic analysis of a Piezo-like protein suppressing systemicmovement of plant viruses in Arabidopsis thaliana. Sci Rep 9, 3187 (2019).
8. Fang,X. et al. AtPiezo Plays an Important Role in Root Cap Mechanotransduction. Int J Mol Sci 22 (2021).
9. Mousavi,S.A.R. et al. PIEZO ion channel is required for root mechanotransduction inArabidopsis thaliana. Proc Natl Acad SciU S A 118 (2021).
10. Li,J. et al. Piezo1 integration of vascular architecture with physiological force.Nature 515, 279-282 (2014).
11. Ranade,S.S. et al. Piezo1, a mechanically activated ion channel, is required for vasculardevelopment in mice. Proc Natl Acad Sci US A 111, 10347-10352 (2014).
12. Wang,S. et al. Endothelial cation channel PIEZO1 controls blood pressure bymediating flow-induced ATP release. JClin Invest 126, 4527-4536(2016).
13. Retailleau,K. et al. Piezo1 in Smooth Muscle Cells Is Involved in Hypertension-DependentArterial Remodeling. Cell Rep 13, 1161-1171 (2015).
14. Zeng,W.Z. et al. PIEZOs mediate neuronal sensing of blood pressure and thebaroreceptor reflex. Science 362, 464-467 (2018).
15. Zarychanski,R. et al. Mutations in the mechanotransduction protein PIEZO1 are associatedwith hereditary xerocytosis. Blood 120, 1908-1915 (2012).
16. Cahalan,S.M. et al. Piezo1 links mechanical forces to red blood cell volume. Elife 4 (2015).
17. Ma,S. et al. Common PIEZO1 Allele in African Populations Causes RBC Dehydrationand Attenuates Plasmodium Infection. Cell173, 443-455 e412 (2018).
18. Huddleston,A.L., Rockwell, D., Kulund, D.N. & Harrison, R.B. Bone mass in lifetimetennis athletes. JAMA 244, 1107-1109 (1980).
19. Haelterman,N. & Lim, J. Sensing the load. Elife8 (2019).
20. Li,X. et al. Stimulation of Piezo1 by mechanical signals promotes bone anabolism. eLife 8 (2019).
21. Sun,W. et al. The mechanosensitive Piezo1 channel is required for bone formation. eLife 8 (2019).
22. Lai,C.C., Shih, T.P., Ko, W.C., Tang, H.J. & Hsueh, P.R. Severe acuterespiratory syndrome coronavirus 2 (SARS-CoV-2) and coronavirus disease-2019(COVID-19): The epidemic and the challenges. Int J Antimicrob Agents 55,105924 (2020).
23. Zhong,M. et al. Alveolar Stretch Activation of Endothelial Piezo1 Protects AdherensJunctions and Lung Vascular Barrier. Americanjournal of respiratory cell and molecular biology 62, 168-177 (2020).
24. Nonomura,K. et al. Piezo2 senses airway stretch and mediates lung inflation-inducedapnoea. Nature 541, 176-181 (2017).
25. Abraira,V.E. & Ginty, D.D. The sensory neurons of touch. Neuron 79, 618-639(2013).
26. Zimmerman,A., Bai, L. & Ginty, D.D. The gentle touch receptors of mammalian skin. Science 346, 950-954 (2014).
27. Proske,U. & Gandevia, S.C. The proprioceptive senses: their roles in signalingbody shape, body position and movement, and muscle force. Physiol Rev 92,1651-1697 (2012).
28. Ikeda,R. et al. Merkel cells transduce and encode tactile stimuli to driveAbeta-afferent impulses. Cell 157, 664-675 (2014).
29. Ranade,S.S. et al. Piezo2 is the major transducer of mechanical forces for touchsensation in mice. Nature 516, 121-125 (2014).
30. Woo,S.H. et al. Piezo2 is required for Merkel-cell mechanotransduction. Nature 509, 622-626 (2014).
31. Chesler,A.T. et al. The Role of PIEZO2 in Human Mechanosensation. N Engl J Med 375,1355-1364 (2016).
32. Woo,S.H. et al. Piezo2 is the principal mechanotransduction channel forproprioception. Nat Neurosci 18, 1756-1762 (2015).
33. Mahmud,A.A. et al. Loss of the proprioception and touch sensation channel PIEZO2 insiblings with a progressive form of contractures. Clin Genet 91, 470-475(2017).
34. Zhang,M., Wang, Y., Geng, J., Zhou, S. & Xiao, B. Mechanically Activated PiezoChannels Mediate Touch and Suppress Acute Mechanical Pain Response in Mice. Cell reports 26, 1419-1431 e1414 (2019).
35. Murthy,S.E. et al. The mechanosensitive ion channel Piezo2 mediates sensitivity tomechanical pain in mice. Sciencetranslational medicine 10(2018).
36. Szczot,M. et al. PIEZO2 mediates injury-induced tactile pain in mice and humans. Science translational medicine 10 (2018).
37. Pathak,M.M. et al. Stretch-activated ion channel Piezo1 directs lineage choice inhuman neural stem cells. Proc Natl AcadSci U S A 111, 16148-16153(2014).
38. Segel,M. et al. Niche stiffness underlies the ageing of central nervous systemprogenitor cells. Nature 573, 130-134 (2019).
39. Solis,A.G. et al. Mechanosensation of cyclical force by PIEZO1 is essential forinnate immunity. Nature 573, 69-74 (2019).
40. Eisenhoffer,G.T. et al. Crowding induces live cell extrusion to maintain homeostatic cellnumbers in epithelia. Nature 484, 546-549 (2012).
41. Gudipaty,S.A. et al. Mechanical stretch triggers rapid epithelial cell division throughPiezo1. Nature 543, 118-121 (2017).
42. Wang,S. et al. Adipocyte Piezo1 mediates obesogenic adipogenesis through theFGF1/FGFR1 signaling pathway in mice. Naturecommunications 11, 2303 (2020).
43. Chen,P. et al. The mechanosensitive Piezo1 orchestrating angiogenesis is essentialin bone fracture repair. bioRxiv(2020).
44. Alcaino,C., Farrugia, G. & Beyder, A. Mechanosensitive Piezo Channels in theGastrointestinal Tract. Curr Top Membr79, 219-244 (2017).
45. Alcaino,C. et al. A population of gut epithelial enterochromaffin cells ismechanosensitive and requires Piezo2 to convert force into serotonin release. Proc Natl Acad Sci U S A 115, E7632-E7641 (2018).
46. Sugisawa,E. et al. RNA Sensing by Gut Piezo1 Is Essential for Systemic SerotoninSynthesis. Cell 182, 609-624 e621 (2020).
47. Jiang,F. et al. The mechanosensitive Piezo1 channel mediates heart mechano-chemotransduction. Nature communications 12, 869 (2021).
48. Marshall,K.L. et al. PIEZO2 in sensory neurons and urothelial cells coordinatesurination. Nature (2020).
49. Li,J. et al. PIEZO2 mediates ultrasonic hearing via cochlear outer hair cells inmice. Proc Natl Acad Sci U S A 118 (2021).
50. Fotiou,E. et al. Novel mutations in PIEZO1 cause an autosomal recessive generalizedlymphatic dysplasia with non-immune hydrops fetalis. Nature communications 6,8085 (2015).
51. Lukacs,V. et al. Impaired PIEZO1 function in patients with a novel autosomal recessivecongenital lymphatic dysplasia. Naturecommunications 6, 8329 (2015).
52. DelleVedove, A. et al. Biallelic Loss of Proprioception-Related PIEZO2 CausesMuscular Atrophy with Perinatal Respiratory Distress, Arthrogryposis, andScoliosis. Am J Hum Genet 99, 1206-1216 (2016).
53. Albuisson,J. et al. Dehydrated hereditary stomatocytosis linked to gain-of-functionmutations in mechanically activated PIEZO1 ion channels. Nature communications 4,1884 (2013).
54. Andolfo,I. et al. Multiple clinical forms of dehydrated hereditary stomatocytosis arisefrom mutations in PIEZO1. Blood 121, 3925-3935, S3921-3912 (2013).
55. Bae,C., Gnanasambandam, R., Nicolai, C., Sachs, F. & Gottlieb, P.A. Xerocytosisis caused by mutations that alter the kinetics of the mechanosensitive channelPIEZO1. Proceedings of the NationalAcademy of Sciences of the United States of America 110, E1162-1168 (2013).
56. Coste,B. et al. Gain-of-function mutations in the mechanically activated ion channelPIEZO2 cause a subtype of Distal Arthrogryposis. Proceedings of the National Academy of Sciences of the United States ofAmerica 110, 4667-4672 (2013).
57. Wu,J., Lewis, A.H. & Grandl, J. Touch, Tension, and Transduction - TheFunction and Regulation of Piezo Ion Channels. Trends Biochem Sci 42, 57-71(2017).
58. Coste,B. et al. Piezo1 and Piezo2 are essential components of distinct mechanicallyactivated cation channels. Science 330, 55-60 (2010).
59. Gao,Y., Cao, E., Julius, D. & Cheng, Y. TRPV1 structures in nanodiscs revealmechanisms of ligand and lipid action. Nature534, 347-351 (2016).
60. Julius,D. TRP channels and pain. Annu Rev CellDev Biol 29, 355-384 (2013).
61. Syeda,R. et al. Chemical activation of the mechanotransduction channel Piezo1. eLife 4 (2015).
62. Wang,Y. et al. A lever-like transduction pathway for long-distance chemical- andmechano-gating of the mechanosensitive Piezo1 channel. Nature communications 9,1300 (2018).
63. Douguet,D., Patel, A., Xu, A., Vanhoutte, P.M. & Honore, E. Piezo Ion Channels inCardiovascular Mechanobiology. TrendsPharmacol Sci 40, 956-970(2019).
64. Boyden,E.S., Zhang, F., Bamberg, E., Nagel, G. & Deisseroth, K.Millisecond-timescale, genetically targeted optical control of neural activity.Nat Neurosci 8, 1263-1268 (2005).
65. Rajasethupathy,P., Ferenczi, E. & Deisseroth, K. Targeting Neural Circuits. Cell 165, 524-534 (2016).
66. Pan,Y. et al. Mechanogenetics for the remote and noninvasive control of cancerimmunotherapy. Proceedings of theNational Academy of Sciences of the United States of America 115, 992-997 (2018).
67. Du, H. et al. The Cation Channel TMEM63B Is an Osmosensor Requiredfor Hearing. Cell Rep 31, 107596 (2020).
作者介绍

刘文豪,清华大学生命学院2016级PTN项目博士生,师从肖百龙教授。博士期间主要从事机械门控Piezo通道结构功能关系的研究,曾以共同第一作者在Nature、Neuron发表文章揭示Piezo通道机械门控过程的“双门控”机制和“门塞和闩锁”机制。
话题:
0
推荐
财新博客版权声明:财新博客所发布文章及图片之版权属博主本人及/或相关权利人所有,未经博主及/或相关权利人单独授权,任何网站、平面媒体不得予以转载。财新网对相关媒体的网站信息内容转载授权并不包括财新博客的文章及图片。博客文章均为作者个人观点,不代表财新网的立场和观点。



 京公网安备 11010502034662号
京公网安备 11010502034662号 