编辑 | 药明康德内容团队
当你因为蚊虫叮咬、过敏或是其他疾病而瘙痒难忍时,有没有思考过:这种令人抓心挠肺的感知,是怎样形成的?
早期的研究认为,痒觉和痛觉的神经机制是类似的——同一类神经元,在低频电信号的刺激下会造成瘙痒;频率升高,则会转化为疼痛。不过随着研究的深入,人们逐渐意识到,痒觉的产生比此前认为的更加复杂而独特。2009年,美国约翰·霍普金斯大学的董欣中教授团队发现,一种G偶联蛋白受体(GPCR)可以在特定化合物的刺激下产生痒觉,这一发现开辟了痒觉受体(MRGPR)的全新研究领域。这个受体后来在人体中被命名为MRGPRX1,揭开了痒觉受体家族的冰山一角。
经过最近几年的研究,痒觉受体家族逐渐扩大。从MRGPRA到MRGPRH,再加上MRGPRX,人们一共发现了9个痒觉受体亚家族,这其中包含了超过50个不同的受体。例如在MRGPRX亚家族中,就有从MRGPRX1到MRGPRX4这4种受体。
面对庞大而复杂的痒觉受体家族,科学家正在努力揭开其中蕴藏的结构与功能信息。本周,《自然》杂志同期发布的两篇论文,利用冷冻电镜揭示了不同痒觉受体在与配体结合时的精细三维结构。

其中一篇论文由孙金鹏教授团队和北京大学高宁教授团队合作完成,这项研究关注的是MRGPR家族中的MRGPRX2。孙金鹏教授表示,其实验室对MRGPRX2最感兴趣,一个原因是实验室不少人有过敏反应,包括花粉过敏。此前的研究已经发现,主要分布在肥大细胞(mast cell)中的MRGPRX2可以感知包括多聚阳离子化合物和短肽等在内的多种分泌素,引起假性过敏反应。
MRGPRX2是如何识别多聚阳离子化合物和短肽的?这项研究给出了回答。
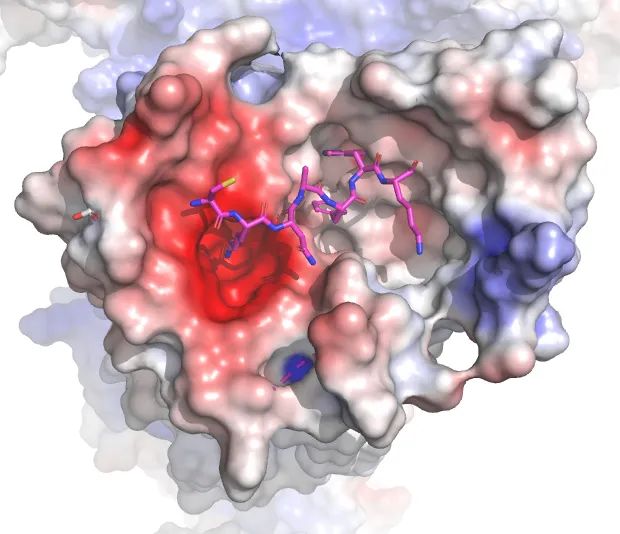
人们已经发现,多种带正电荷的碱性小分子可以激活MRGPRX2。这项研究解析了当这些小分子作用时,MRGPRX2与Gi三聚体复合物的结构。结果发现:MRGPRX2结合口袋上的两个酸性氨基酸,可以识别小分子上正电荷的碱性基团,从而与小分子结合。此外,研究团队还找到了能够被MRGPRX2识别的短肽的通用序列,含有这一序列的内源短肽和短肽类药物能够激活MRGPRX2、引发瘙痒。
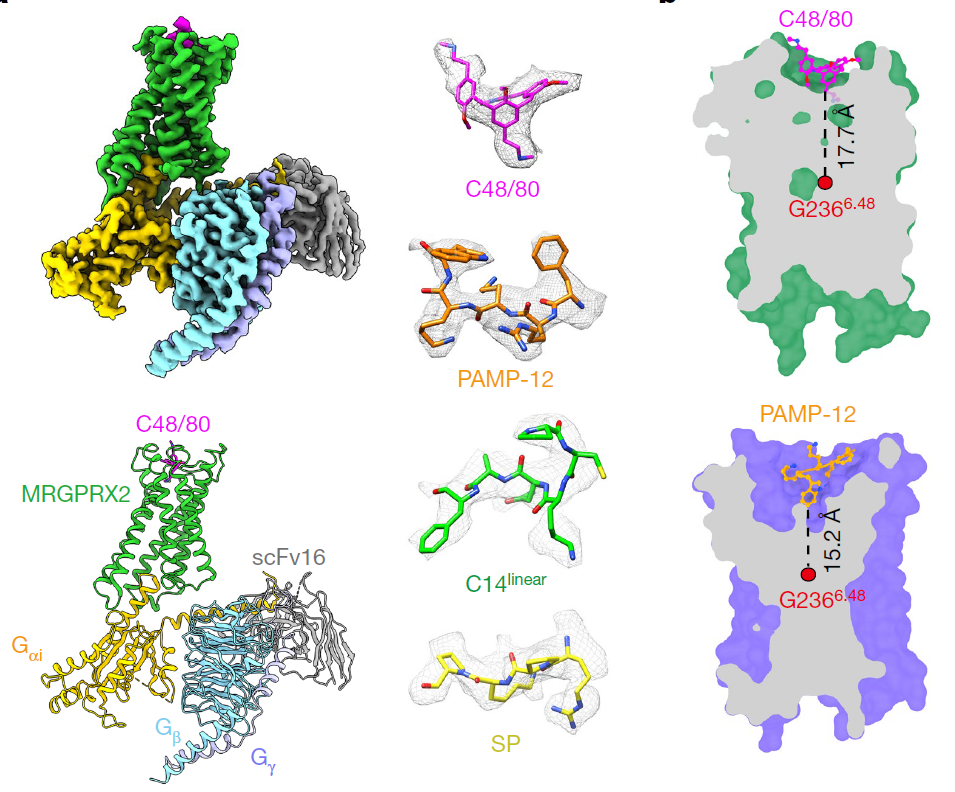
在冷冻电镜下,MRGPRX2与配体结合形成的结构丨图片来源:参考资料[1]
科学家在临床上注意到,某些药物也会激活MRGPRX2受体,引发组织胺的释放,从而诱发瘙痒的副作用。而这个短肽通用序列的发现,为能避免这一副作用的药物的研发提供了重要的理论依据。此外,这项研究还揭示了MRGPRX2独特的激活机制,扩展了人们对痒觉受体家族激活机制的认识。

而在同期发表的另一篇论文中,来自美国北卡罗来纳大学教堂山分校和加州大学旧金山分校的研究人员同样利用冷冻电镜解析了MRGPRX2的分子结构,并且筛选出了能够抑制MRGPRX2激活的高效拮抗剂。
另外,这项研究还对痒觉受体家族的另一个成员MRGPRX4进行了详细的解析。MRGPRX4位于感知痒觉的神经元上,之前的研究已经发现,这个受体被激活时,可以造成肝病胆汁淤积患者的瘙痒症状。
多肽激活MRGPRX2的示意图丨图片来源:UNC SCHOOL OF MEDICINE (ROTH/FAY)
为什么同属一个亚家族,但MRGPRX4无法像MRGPRX2一样识别带正电荷的分子,而是与带负电的胆酸相结合?这项研究解析了MRGPRX4的结构之后发现,MRGPRX2中的两个酸性氨基酸被受体在胞外的部分遮挡住,因此在MRGPRX4中,它们无法识别正电荷分子;相反,序列的改变使得结合口袋带正电,这也解释了它们造成的胆汁淤积瘙痒。
这两项重磅研究首次让我们看见了痒觉受体的真正面目,也为更多关于痒觉的基础研究与药物研发奠定了坚实的基础。相信随着更多后续研究的进行,关于痒觉这种神秘感知的更多谜题也终将被揭开。
专家点评
董欣中(约翰·霍普金斯大学,神经科学系教授)痒觉是大家每天都能感受到但又不太清楚的一种感觉。那么痒觉到底是怎么产生的呢?原来,皮肤内的感觉神经末梢存在的一些痒觉受体,能够探测到皮肤上引发痒觉的刺激物。另外皮肤内的一些免疫细胞,比如肥大细胞,也可以通过其他痒觉受体来激活并释放组胺(histamine)进而引起痒觉。
二十年前,我在加州理工学院David Anderson教授实验室做博士后时发现的一组全新的G偶联蛋白受体(GPCR)亚家族,我们给它起名为MRGPR(包括50个小鼠Mrgprs 和8个人类MRGPRs)。起初我们并不清楚MRGPRs的功能是什么,此后十多年在我们实验室和其他团队的共同努力下,我们发现一些MRGPRS是上面提到的存在于感觉神经和肥大细胞上的痒觉受体,其中就包括MRGPRX2和MRGPRX4。
今天要点评的两篇论文是近期同时发表在《自然》杂志上,关于解析MRGPRX2和MRGPRX4三维蛋白结构的研究成果。一篇由孙金鹏团队和北京大学高宁团队合作完成,另一篇由来自美国北卡罗来纳大学教堂山分校的Bryan Roth团队和加州大学旧金山分校的研究人员合作完成。解析MRGPRX结构是具有挑战性的,因为这种GPCR的蛋白质序列非常短,其中大部分隐藏在细胞膜里,所以用蛋白质结晶的方法去解析结构是不太可能的。孙金鹏教授和Roth教授是GPCR药理学家和冷冻电镜专家,他们两个团队利用这种技术解析了痒觉受体MRGPRX2 和MRGPRX4的高分辨率的蛋白结构。这是二十年来第一次看到痒觉受体的模样,所以我非常高兴。
这两篇论文的发表也是MRGPR研究领域的一个重要里程碑。MRGPRs和大家熟悉的GPCR不太一样。大部分GPCR由一两个非常特异的配体激活;而一个MRGPR却可以被许多不同的低亲合度配体激活,这些配体包括小分子化合物和短肽。最好的例子就是肥大细胞上的MRGPRX2。我们发现MRGPRX2可以被几十种临床上使用的小分子药物和体内的短肽激活。这些药物可以通过MRGPRX2使得肥大细胞释放组胺和其他介质,引起包括呼吸困难、体温下降、红肿和瘙痒在内的药物过敏症状。
那么为什么这么多物质都可以激活MRGPRX2?这两个研究结果完美地解释了这个困惑我们多年的问题。从蛋白结构可以清楚地看到原来MRGPRX的配体结合口袋比一般的GPCR都浅,这样就有利于不同的配体进入口袋激活受体。另外他们的研究也找到几个配体结合的重要位点,从而很好地解释了为什么MRGPRX2的众多配体都带有正电荷而MRGPRX4的配体却是各种带负电荷的胆汁酸。胆汁酸是造成肝病胆汁淤积患者出现瘙痒症状的重要分子。
他们两个团队的结构研究还展示了MRGPR下游可以结合不同的G 蛋白,为以后进一步的信号传导研究起到了指导作用。另外这次解析MRGPR蛋白结构的研究还对药物开发研究起到了指标性的作用。如上所述,许多临床使用的药物可以通过MRGPRX2引起危险的药物过敏反应。了解这个受体的结构后,人们在研发新药时就尽量避免那些能结合MRGPRX2配体结合口袋的分子结构,从而降低药物的副作用。
另外这两篇论文也使得开发MRGPR的抑制物变得更加有的放矢了。除了瘙痒外,MRGPR还对许多疾病(如疼痛、炎症、皮肤病等)起到了推导的作用。希望在不久的将来,能通过抑制MRGPRS来治疗疾病、造福人类。
参考资料
[1] Yang, F., Guo, L., Li, Y. et al. Structure, function and pharmacology of human itch receptor complexes. Nature (2021). https://doi.org/10.1038/s41586-021-04077-y[2] Cao, C., Kang, H.J., Singh, I. et al. Structure, function and pharmacology of human itch GPCRs. Nature (2021). https://doi.org/10.1038/s41586-021-04126-6[3] Researchers reveal structure of itch receptors on cells. Retrieved Nov 17th, 2021 from https://www.eurekalert.org/news-releases/935319
本文经授权转载自微信公众号“学术经纬”,原题目为《同日两篇《自然》!中美科学家看清“痒”的真实面目 | 董欣中教授深度点评》。
0
推荐



 京公网安备 11010502034662号
京公网安备 11010502034662号 