自去年底新冠病毒Omicron变异株出现之后,新的亚系毒株层出不穷,引发了世界各国又一波疫情高潮。不过,Omicron及其亚系所造成的重症率和死亡率相较于此前的新冠原始毒株和Delta变异株来说都大幅下降了。这些新变体的传染性和逃逸抗体中和的能力较过去大大增加,幸运的是,每个人做好防疫三件套,便可以将感染风险降到最低。
撰文 | Kestrel
疯狂突变
近半年来,科学家们找到了多个新冠病毒Omicron变异株的亚系毒株。其中BA.4、BA.2.12.1、BA.5首先在南非和美国发现,导致当地确诊病例再度上升。这些Omicron新亚系的免疫逃逸能力变得更强,到目前为止,还不清楚这些新的亚型毒株会不会像之前的BA.1和BA.2那样,在去年冬季造成全球范围内的感染病例数激增。
威尔·康奈尔医学院(Weil Cornell Medicine)的免疫学家John Moore称,没有必要惊慌,这些新毒株固然会带来新的麻烦,但没有证据显示它们比先前的Omicron毒株更危险或更具致病性。且接种过疫苗或曾感染过新冠病毒后,仍可以降低大多数新亚系造成的重症率。不过,新的亚系可能会改变制药公司发布针对特定亚系疫苗的计划[1]。尽管南非和美国的感染人数和住院人数都在增长,但研究者认为,特定变异亚系造成的一波波感染将变得越来越可预测。
新冠病毒Omicron变异株(B.1.1.529)最初于 2021年11月在博茨瓦纳发现,很快又在南非发现[3]。Omicron复制的速度比Delta变异株快,二次感染率也更高。有一项在卡塔尔的研究显示,相比首次感染的人,得过新冠的人再次感染Alpha(B.1.1.7),Beta(B.1.351)和Delta(B.1.617.2)的风险会降低85%到90%,而再次感染Omicron的风险只降低了56%。人们还不清楚Omicron是否本身就具有更强的传染性,但目前有尚未发表的体外研究显示,相比Delta,Omicron偏好在鼻腔上皮细胞和支气管组织中复制,这可能是它传染性更强的原因之一 [6]。另外,Omicron的感染症状相对不那么严重,一项英格兰的分析显示,感染Omicron的住院和死亡风险大概为Delta的1/3。[2]
Omicron变异株出现后不久,大约同一时间,它的两个亚系毒株BA.1和BA.2也在南非被发现,BA.2一出现就迅速取代了先前流行的BA.1。2022年1月,BA.2首现美国;3月开始在上海发现的大规模感染也正是BA.2引起。与一开始最初版本的新冠病毒(SARS-CoV-2)相比,BA.2和BA.1共同拥有32个突变;BA.2另外拥有28个有别于BA.1的突变,其中一些突变位点所在的基因片段正是负责编码受体结合域(receptor binding domain,RBD)的,会影响病毒与宿主受体的结合。因为核酸检测结果难以与Delta的检测结果区分,BA.2又被称为“隐形Omicron”(stealth Omicron),其传染性比原始版本强大概1.5倍。截止到4月中旬,BA.2感染病例占到美国全部新冠感染病例的90%,但并没有造成新一轮大幅度传播,部分是因为先前BA.1感染带来的免疫保护。
今年4月,纽约又发现了Omicron毒株的BA.2.12.1亚系,它和BA.2亲缘关系密切,但传染性还要强25%。4月30日,我国国内发现首例BA.2.12.1感染者,为广州的境外输入病例[8]。根据美国CDC于5月17日发布的数据,BA.2.12.1感染现在占到美国所有病例的48%。CNBC(美国消费者新闻与商业频道)则报道称,截至5月11日,BA.2.12.1已经出现在23个国家[12]。
然而,Omicron并没有停止变异,更没有停下传播的脚步。4月29日,我国国内发现首例BA.5感染者,为上海的境外输入病例,该病人已于5月12日恢复健康[10];5月4日,又发现首例BA.4感染者,为广州的境外输入病例[9]。
实际上,早在今年1月,BA.4和BA.5就在南非露出苗头,但病例激增是最近才发生的:从4月17日到5月7日,每日确诊病例数暴涨了10倍(从每日千例涨到了每日万例),可见这两个亚系比BA.2更具传染性。南非约翰内斯堡金山大学(University of the Witwatersrand in Johannesburg)病毒学家Penny Moore说:“南非的疫情肯定是死灰复燃了,而且看起来完全是BA.4和BA.5驱动的。感染人数又爆增了。单单我实验室里面就有6名学生生病请假。”截至5月17日,除南非以外,全球已有17个国家出现BA.4感染,总计不超过700例;有16个国家出现BA.5感染,总计不超过300例。
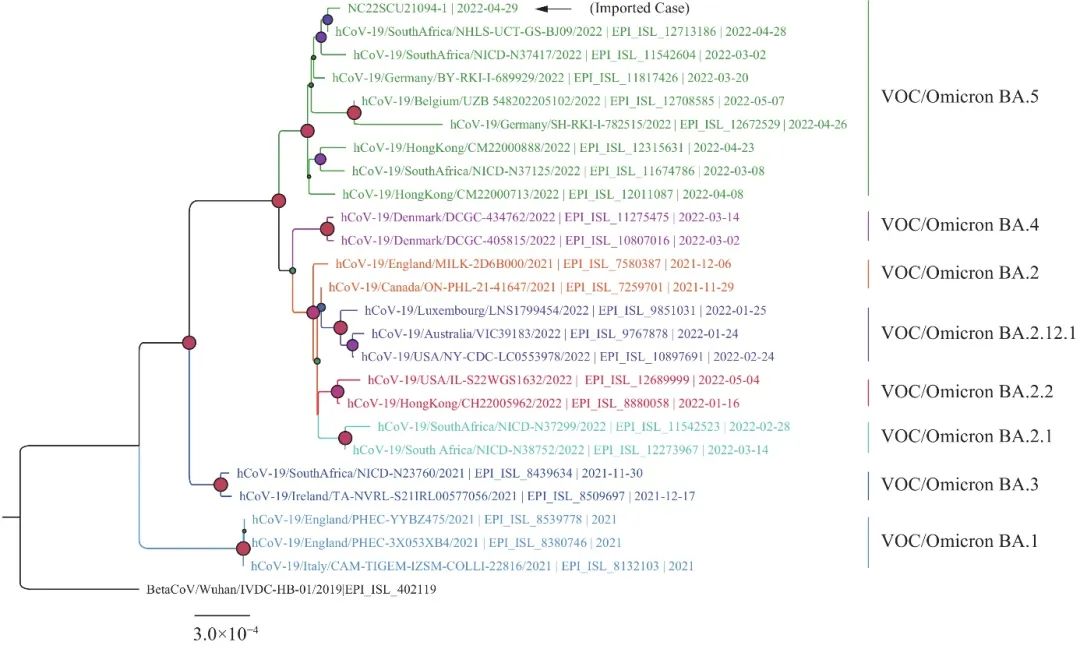 图1 近期发现的SARS-CoV-2变体系统发生树。[10]
图1 近期发现的SARS-CoV-2变体系统发生树。[10]
免疫逃逸
今年5月2日发表在medRxiv上的一篇预印本文章称,与BA.1相比,BA.4和BA.5具有更强的免疫逃逸能力,即便是打了疫苗或者曾感染过BA.1,也可能无法避免再次感染BA.4或BA.5。南非的研究人员在2021年11月和12月期间收集了曾感染过BA.1的患者的血样,包括接种或未接种疫苗的病例。经检测,这些血样中的抗体中和BA.4和BA.5亚株的能力比中和其他Omicron亚系的能力低好几倍。不过,尽管如此,接种过疫苗的人的抗体还是更有效一点。这可能是因为南非BA.1亚系流行的那一波过去以后,人们体内对BA.1的免疫力逐渐消退了。
同日,另一篇发表在bioRxiv上的预印本文章也报道,感染过BA.1后恢复的病人的抗体在实验室条件下对BA.4、BA.5及BA.2.12.1亚系的中和能力不如对BA.1亚系的中和能力。在这项研究中,国内的一个团队基于新突变株的DNA序列合成了其刺突蛋白,然后测试了不同抗体阻止其结合细胞表面受体的能力。研究者收集了156份血样,每个人都打了疫苗及加强针,其中有些感染过BA.1,还有些是20年前感染过SARS-CoV-1病毒的幸存者。与南非团队类似,他们也发现感染过BA.1的受试的血样中和BA.4、BA.5及BA.2.12.1的能力要比中和BA.1的能力弱一些。有趣的是,他们还发现,在感染过BA.1的受试中,打过疫苗的受试的血样中和能力甚至不如没打过疫苗的受试。
去年12月,纽约哥伦比亚大学何大伟(David Ho)教授就曾在Nature发文称Omicron变异株对先前广泛使用的四种疫苗均具有显著的抗体逃逸能力。目前,他的团队已发表预印本报道BA.2发展而来的亚系 BA.2.12.1 和 BA.4/5具有更强的抗体逃逸能力。
 图2 Omicron各亚株刺突蛋白上的突变。[11]
图2 Omicron各亚株刺突蛋白上的突变。[11]
前述发表在bioRxiv上的文章指出了新变体具有通过逃避抗体中和的方式来实现免疫逃逸的能力。BA.4、BA.5及BA.2.12.1携带的突变改变了刺突蛋白452位的亮氨酸(L452),病毒正是通过其刺突蛋白结合细胞表面受体进入细胞的,所以刺突蛋白氨基酸序列的变动就导致了刺突蛋白结合性质的改变。L452所在的结构域也是抗体结合的关键位点。L452处于病毒的高变区,这里出现4种不同的突变,研究者怀疑,这是疫苗接种和大规模Omicron感染带来的高度群体免疫带来的选择压力所造成的后果,能够逃逸免疫的突变集中留存了下来。Delta突变株在452位点也有重要的突变,所以许多科学家正在密切关注该位点[4]。
何大伟认为,这些毒株的出现提示了Omicron变体已经、并将持续进化出更具有传染性和抗体逃逸能力的亚系。
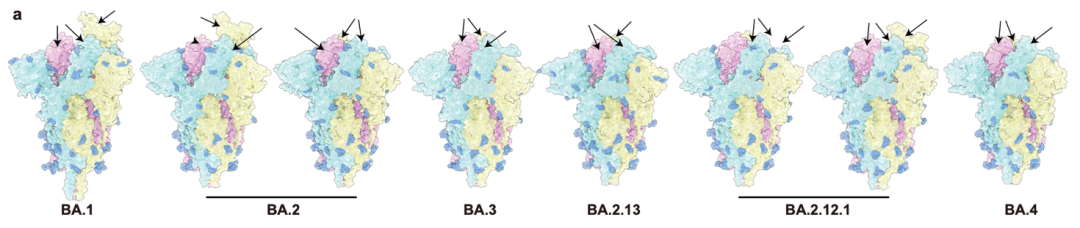 图3 Omicron各亚系毒株的刺突蛋白三聚体的表面结构。[11]
图3 Omicron各亚系毒株的刺突蛋白三聚体的表面结构。[11]
5月26日发表在bioRxiv上的一篇预印本文章报道,相比BA.2亚株,BA.2.12.1对接种者血清的抵抗能力只强了1.8倍,而BA.4和BA.5的抵抗能力则强了4.2倍,因此后两者更容易造成突破感染。BA.2.12.1、BA.4和BA.5氨基酸位点L452上的突变能够帮助它们逃脱靶向2类和3类受体结合域的抗体。BA.4和BA.5携带的F486V突变能够帮助它们逃脱靶向1类和2类受体结合域区域的抗体,同时也损害了它们对细胞受体ACE2的亲和力。但是,R493Q回复突变又恢复了它们对ACE2的亲和力。现临床使用的治疗性抗体中只有礼来开发的bebtelovimab(LY-COV1404)仍对BA.2.12.1、BA.4和BA.5保持着完全的中和效力。[7]
疫苗开发与抗体治疗
在实验室研究中,BA.1感染产生的对新亚系毒株的免疫力很有限,因此不乏有声音质疑莫德纳(Moderna)、辉瑞/BioNTech和其他制药公司正在开发的、针对Omicron的疫苗是否有效。莫德纳已经测试了两个版本的mRNA疫苗,一种包含原始新冠病毒和Beta毒株的序列,另一种包含原始新冠病毒和Omicron BA.1亚系毒株的序列,但还没有报告这两个版本对新亚株的效果。辉瑞/BioNTech也测试了一种加强针和另一种基于BA.1的疫苗的效果,预计六月底才能出结果。FDA会在6月28日分析数据并推荐秋季使用的疫苗。
杜克-新加坡国立大学医学院(Duke-NUS Medical School)病毒专家王林发认为,病毒进化的脚步太快了,针对特定亚株的疫苗研发跟不上,未来应对突变株的更好办法可能是针对多种亚系毒株的广谱单克隆抗体鸡尾酒(即联用多种单抗)。
已有研究发现,从感染过新冠病毒原始毒株的康复病人血液中分离出来的抗体F61能够中和BA.1、BA.1.1、BA.2、BA.3和BA.4 等五种变体,另一个结合不同抗原表位(epitope,决定抗原与抗体结合特异性的位点)的抗体D2则能够中和除BA.1.1和BA.4以外的几种突变株。如果两种抗体联用,会表现出协同作用,能够在体外中和上述所有亚系[5]。采用这类广谱中和抗体,将会是抗体治疗的主流。
对重病易感的人群(包括免疫缺陷的人群)而言,鸡尾酒治疗方法可能提供长达几个月的保护。王林发认为,保护这些易感人群很重要,因为许多研究者怀疑,新的突变株正是从那些长期感染者体内出现的,他们的免疫系统没能够清除病毒。
鸡尾酒疗法的主要阻碍是极其昂贵的价格——每人每剂需要1000美元。另外,它的研发周期可能也不短。如果有人能将花费降到50或100美元,鸡尾酒疗法就有可能成为阻止新冠长期传播的有效策略。这甚至可能比不断更新疫苗更划算。
预测:下一波疫情
虽然在欧洲和北美都发现了BA.4和BA.5突变株,但它们可能不会造成新一波疫情,至少目前不会。比利时天主教鲁汶大学(Catholic University of Leuven in Belgium)演化生物学家Tom Wenseleers认为,它们和BA.2亲缘关系很近,而后者刚在欧洲扫荡过一圈,所以那里人群的免疫力可能还很高。因此,它们对欧洲的影响可能会小一些。
如果新冠病毒继续沿现在的路径演化,它有可能会变成一种季节性的呼吸系统疾病。新冠病毒感染的模式会变得越来越有迹可循,因为新突变总会利用群体免疫机制的缺陷来入侵,驱动其周期性的传播。科学家们可能越来越准确地预见人群对COVID-19的免疫力的持续时长,以及新一波疫情何时到来。西雅图弗雷德·哈钦森癌症研究中心(Fred Hutchinson Cancer Research Center in Seattle)的病毒演化生物学家Jesse Bloom则认为,这是一种解读目前疫情观察结果的方式,但我们应该保持谨慎,因为观察时间尺度还太短,不足以外推到更广泛适用的规律。
病毒变异节奏那么快,幸运的是,我们是能以不变应万变的。控制传染病的三大措施——控制传染源、切断传播途径、保护易感人群也适用于新冠。防疫三件套,我们每个人都做得到:勤洗手,戴口罩,保持社交距离,便可以将感染风险降到最低。
参考文献
[1] https://www.the-scientist.com/news-opinion/what-you-should-know-about-new-omicron-subvariants-70012
[2] https://www.uptodate.cn/contents/covid-19-epidemiology-virology-and-prevention
[3] https://www.yalemedicine.org/news/5-things-to-know-omicron
[4] https://www.science.org/content/article/new-versions-omicron-are-masters-immune-evasion
[5] https://www.biorxiv.org/content/10.1101/2022.05.27.493682v1
[6] https://www.biorxiv.org/content/10.1101/2021.12.31.474653v1
[7] https://www.biorxiv.org/content/10.1101/2022.05.26.493517v1
[8] https://weekly.chinacdc.cn/en/article/doi/10.46234/ccdcw2022.094
[9] https://weekly.chinacdc.cn/en/article/doi/10.46234/ccdcw2022.095
[10] https://weekly.chinacdc.cn/en/article/doi/10.46234/ccdcw2022.104
[11] https://www.biorxiv.org/content/10.1101/2022.04.30.489997v1
[12] https://www.cnbc.com/2022/05/11/who-says-omicron-bapoint4-and-bapoint5-subvariants-have-spread-to-over-a-dozen-countries.html#:~:text=Another%20omicron%20subvariant%20called%20BA.2.12.1%20has%20been%20detected,subvariant%2C%20most%20of%20which%20comes%20from%20the%20U.S.
0
推荐



 京公网安备 11010502034662号
京公网安备 11010502034662号 