撰文 | 翁羽翔 (中国科学院物理研究所)
来源 | 本文选自《物理》2022年第10期
在《人间词话》一书中,王国维先生用诗词来形象地概括做学问的三重不同境界。如果把它们用在科研上,第一重便是选题,做到眼界要高:“昨夜西风凋碧树,独上高楼,望尽天涯路”;第二重当是主观努力,无怨无悔:“衣带渐宽终不悔,为伊消得人憔悴”;第三重才是收获,功夫做足后,成果看似得之偶然,其实是取之必然:“众里寻他千百度。蓦然回首,那人却在,灯火阑珊处”。这三重境界之说不知令多少前赴后继的学子折服,尤其是那些经历过“登高楼,蓦然回首,人憔悴,终不悔!”、拥有壮阔而惆怅人生阅历的人。
如果用自己的体会把这三个境界进一步凝练,不妨可以概括为三个字:“觉、悟、道”。“觉”是感性如视、听、嗅、触、味觉,是主观对客观的感知。在外部刺激下,会激发非理性的发散性思维,同时也表现出很大的个体差异。“悟”是由感觉触发的理性思考和逻辑实证,起点和路径可以是各不相同,而到达的终点只有一个,那就是悟道。“道”是觉与悟相互作用后获得的相对真理。如屠呦呦教授在东晋葛洪所著的《肘后备急方》中看到“青蒿一握,以水二升渍,绞取汁,尽服之”之句,就是“觉”的境界;由“水渍、绞取汁”想到新鲜青蒿的有效成分可能会在通常的热萃取过程中被分解,于是便改用了以沸点为35℃的乙醚作为萃取剂进行提取,从而最终获得青蒿素的晶体及药理实验结果,到达“悟”的阶段;最后从分子结构上 (含有一个活泼的过氧桥) 阐明了青蒿素分子能够杀灭疟疾原虫的机制才升格为“道”的境界[1]。
本文拟从日常生活中口口相传的“喝热茶明目”这一感性经验入手,依据新近发表的、题为“热诱导下α晶状体蛋白发挥分子伴侣功能抑制γD晶状体蛋白在紫外辐照下发生聚集沉淀的分子机制”的研究工作[2],试图揭示其背后蕴含的科学机制,即“道”。在简要介绍人眼晶状体构造及部分晶状体蛋白质结构的基础上,阐明热激活α晶状体分子伴侣活性及其保护紫外损伤γ晶状体蛋白、阻止紫外辐照损伤导致白内障的机制。最后给出合理保护晶状体的几点原则性建议。
01、引 言
“黑夜给了我黑色的眼睛,我却用它来寻求光明。”多少人在漫长的寻求光明的一生中,眼睛由黑色慢慢变成白色,白天也变成了漫漫的黑夜。然而这一结局也并非是每个人的宿命。还有不少人,到了耄耋之年,还能够保持双眼明亮清澈,还能读书看报,因此生命一定存在一种自我修复,阻止病变发生、发展的机制。尽管现代医学的进步,可以通过手术,得以重见光明。
都说眼睛是心灵的窗户,是窗户就有被蒙上尘埃的风险。外面的风沙吹入眼睛,用水冲一冲就能够解决问题。而由内部蒙上阴翳如白内障,那就非得动手术,来个彻底解决不可。一般说来,任何疾病应该都有一个可以“防”的阶段,破“防”了,再考虑“治”。
如今进入信息爆炸的时代,不管有用的还是没用的信息,绝大部分是靠眼睛阅读来获取的。现代人的各项健康指标和先辈相比,有多方面的改善,唯独眼睛一直在退步。那么又有什么简单易行的方法能够保证双眸的清澈呢?
神秀禅师有偈云:“身是菩提树,心如明镜台。时时勤拂拭,勿使惹尘埃。”该偈的出发点,就是一个“防”字,给出的办法是“拂拭”。然而,对于眼睛来说,“外拂”易做,但是“内拭”谁也不知如何下手,甚至都不知道是否存在。
生命是自然界进化的产物,也许早已把“内拭”的秘诀隐藏在机体里,只是我们尚未认识到而已。祖辈在日常生活中也曾经摸索到各种法门,但只是停留在感觉的层次,尚无法达到知其所以然的境地,极大地降低了可信度。比如喝茶能明目之说,古已有之。明代李时珍在《本草纲目》中写道:“茶苦味寒……最能降火,火降则上清矣”;明代钱春年、顾元庆在《茶谱》中就肯定茶能“明目益思”。在网上搜索“茶能明目”这一条目,就能够从“好医生”专栏中跳出“茶可以起到明目的作用,一定要选择一个刚刚泡好的茶或者是热茶”。那么为什么一定是热茶呢?
本文撇开茶的化学成分不谈,单独挑出一个“热”字,古人和今人过分关注茶的化学成分所引起的药理学作用,而偏偏忽略了热茶这一靠物理温度去激活、生命个体自带的生理机制!因为喝热茶的时候双眼躲不开升腾的热蒸汽,无意中受到了热茶的熏蒸。这不禁让我回想起了十多年前在武夷山休闲酒店体验到的茶道表演情景。
唐宋以后,茶道文化在中华故国几近失传,即使在福建茶乡,也是属于表演性质的,但多少会保留一些古韵。在品茶之前至少还有两道程序,一是闻香,二是熏眼。在一个一握大小的青花瓷筒内注入刚泡好的热茶,嗅完茶香后,低头紧扣在眼眶上,让带着茶香的蒸汽热腾腾地扑向眼球。当时就令人感到有些奇怪:对于品茶而言,熏蒸眼睛又怎么能够辨识茶的好坏呢?直到现在才恍然大悟,原来这一招早就暗藏了眼睛保健的玄机。
去年春天,因为疫情原因,学生大都无法按期回所,在静静的大楼里,把已经做了好多年、屡投不中的关于α晶状体抑制紫外线辐照损伤γ晶状体聚集,其分子伴侣活性随温度升高的实验结果,从热力学及分子组装体结构的角度进行重新分析,没想到大有发现和感悟。正巧中国科学院理论物理研究所蔡荣根院士打电话来,诉说眼睛难受得要命,问我有什么办法。估计蔡老师目前这种状态下做白内障手术还太早,就推荐了依据研究心得给出的方法:热敷。一个月后再见到蔡老师,他说那些不适症状都已消失了!
02、眼睛晶状体的构造
眼睛是生命体中的一个集光学成像、图像读出及传输的复杂系统,包括屈光和感光系统。晶状体是屈光系统中最重要的组成部分,它呈双凸透镜状,通过睫状肌的调节改变屈光度,使外界光线能够准确地聚焦在视网膜上。对于人的晶状体来说,水约占66%,其余为蛋白质,是人体内水含量最少而蛋白质浓度最高的组织[3,4]。
晶状体的折射率为1.437,角膜为1.3771,玻璃体为1.336,而房水为1.3374。可见晶状体的折射率显著高于后三者,因此晶状体蛋白质必须保持高度的稳定性和水溶性。为了维持其透明性和折射率,晶状体纤维细胞精确排列,细胞内聚集高浓度的晶状体蛋白。若晶状体纤维细胞排列紊乱或者蛋白质受到损害,会导致晶状体透明度丧失,形成白内障。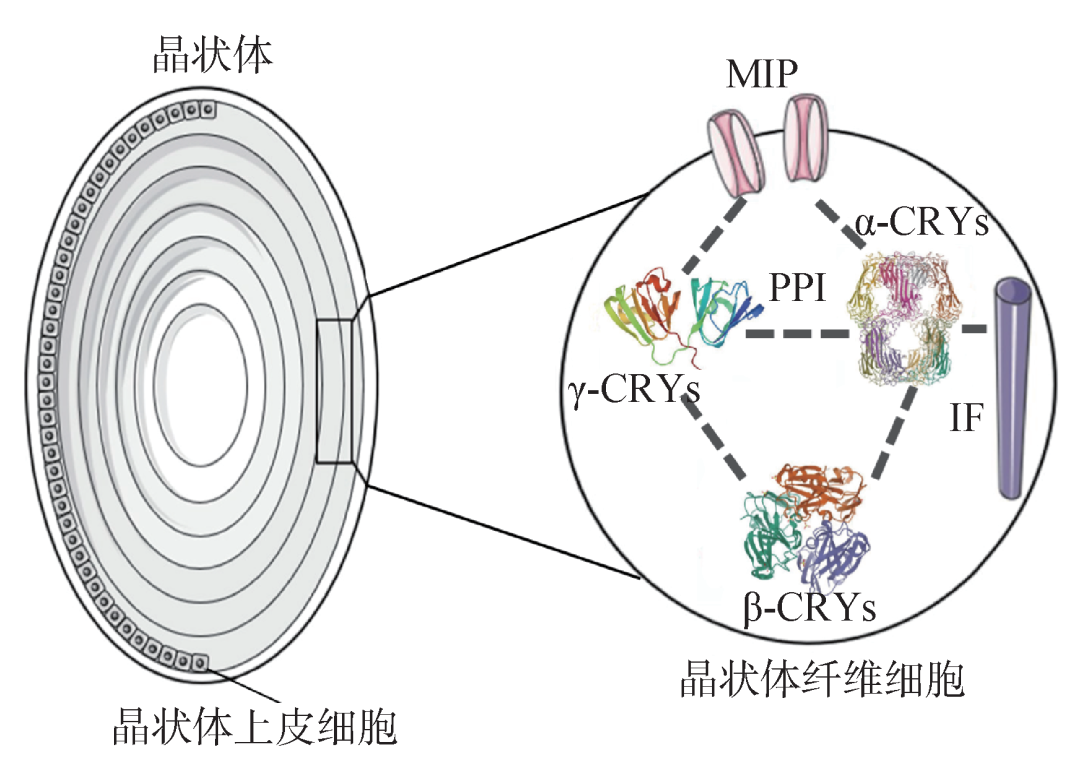
图1 眼睛晶状体结构(左)和细胞内晶状体蛋白相互识别及相互作用(右)。其中,MIP是主要内在蛋白,CRYs是晶状体蛋白,PPI是蛋白相互作用,IF是中间纤维
晶状体发源于胚胎阶段的外胚层,随着发育的进行,上皮细胞一层层覆盖在中心晶体核的表面,并向两端伸长,分化成为纤维样细胞。伴随着细胞分裂的停止,细胞核逐渐消失,包裹在纤维细胞内部的细胞群也将停止代谢,由于无法被新生细胞取代,胚胎早期形成的结构将长期存在于晶状体的内部[5]。与人体器官的其他蛋白质不同,晶状体蛋白是不可再生的,也就是说,晶状体蛋白一旦形成,就要使用一辈子,因而一旦晶状体出现损伤,就有可能对眼睛造成不可恢复的损害。
晶状体虽然是多细胞结构,但其电/化学活动类似于一个大的合胞体或单个细胞。因为晶状体前囊膜内侧存在一层代谢活跃的上皮细胞,而后囊膜内侧则缺少这层上皮细胞(图1)。晶状体内许多物质都存在着从前到后、由浅入深的离子梯度:水的含量在中心晶状体最低,近表面最高;晶状体蛋白的含量则相反,内核最高;pH值则以晶状体中心最低,表面最高;细胞内钾离子在前表浅纤维中最高,在核和后极纤维中最低;钠离子的分布则与钾离子相反。水、离子和其他小分子能自由通过晶状体囊膜,蛋白质 (分子量:70 kDa,分子直径:7.4 nm) 也能通过囊膜。正常眼睛中γ晶状体蛋白能漏出到房水中。人眼晶状体纤维细胞膜表面约5%为孔道分布,孔道处于开放状态,使代谢物质得以快速交流,协调细胞间的生理活动。组成孔道的分子可能是主要内在蛋白 (major intrinsic protein,MIP),是细胞膜上的一类具有选择性运输水分的特异孔道蛋白,是调控水分进出晶状体最主要的途径,维持其透明性[4,6]。由于晶状体经常需要面对紫外线照射等,会产生氧化性化学物质,因而晶状体外部的房水中经常包含平均浓度约30 μM的过氧化氢分子。
同时,晶状体内也含有相应的抗氧化物质保护其免受氧化损伤,如还原型谷胱甘肽 (G-SH) 中的巯基 (-SH) 能保护晶状体蛋白的巯基不被氧化成二硫键,超氧化物歧化酶和过氧化氢酶等参与将自由基和过氧化氢还原成水的过程,生理状态下氧化和还原两者处于动态平衡。由于晶状体内部没有体液循环系统,而其内环境中的谷胱甘肽等还原性分子却会在抗击氧化损伤的过程中不断被消耗掉,因而晶状体内部还原性环境依赖于一个由多种通道蛋白驱动的“晶状体内液体循环体系”进行不断更新。维持该体系的驱动力是由细胞间间隙连接、钠/钾离子通道和水通道等由多种细胞通道共同提供的。由晶状体液体循环体系维持的内部还原性内环境,可以有效地保护晶状体中的蛋白质在漫长的生理时间内不被氧化。在健康的晶状体中,即便是60岁以上的中老年人,其晶状体蛋白也几乎不会受到氧化修饰和损伤[7]。
哺乳动物的晶状体蛋白大致分为α、β和γ三类。α晶状体蛋白在晶状体中的含量超过晶状体蛋白总量的50%。α晶状体蛋白包括αA和αB晶状体蛋白,以多聚体形式存在,且多聚体中所含单体数量不等,具有多分散性。β晶状体蛋白形成复杂的寡聚体结构,只有γ晶状体蛋白通常以单体形式存在。这三类晶状体蛋白彼此之间相互作用,维持一个动态平衡,从而保持晶状体的透明性。随着年龄的增长,热辐射、紫外线照射等环境因素会诱导晶状体内蛋白错误折叠甚至变性聚集,蛋白质逐渐失去其水溶性和稳定性。不溶性聚集体蛋白的累积使得晶状体变得部分或者全部浑浊而导致白内障。北京大学人民医院眼科鲍永珍教授(我们研究工作的合作者)等对中国西部农村地区2003—2005年50岁及以上人群老年性白内障患病率调查结果显示:青海41.8%、云南48.2%、贵州18.8%、广西39.4%,远高于东部地区的白内障患病率。西南部地区海拔较高、纬度较低,紫外线辐射相对较高是造成这一结果的主要原因[8]。可见紫外线辐照损伤是自然衰老过程中引起老年性白内障的主要危险因素。
03、α晶状体蛋白:聚集体结构及热力学不稳定性
α晶状体在体外通常以30—50聚集体的形式存在,分子量在700—800kDa之间,并且通常以两种亚型αA (173个氨基酸残基) 与αB (175个氨基酸残基) 晶状体形成聚集体,两者间的摩尔比约3:1,前者的疏水性要大于后者。与β、γ两种蛋白相比,α晶状体蛋白属于小热休克家族的一员,发挥分子伴侣 (molecularchaperone) 的活性,包括识别错误折叠晶状体蛋白,维持晶状体蛋白正确结构[9],可以在一定程度内维持底物蛋白的稳定,抑制β、γ晶状体蛋白在高温、紫外、氧化诱导下发生不可逆聚集。
由于α晶状体聚集体中所包含的单体个数的多分散性,并且在温度高于4℃的条件下,溶液中就已经存在单体从聚集体上脱落并重新回到聚集体上的动态平衡,单体在聚集体中如何组装的结构信息 (蛋白质的四级结构) 尚无法通过X-射线衍射或冷冻电镜获得[10]。目前所报道的结构都是单一的αA或αB寡聚体的结构。正因为如此,人们只能依据已有的实验事实,提出了数个不同的α晶状体聚集体的结构模型。其中一个模型是生物学家提出的三层核壳模型:实验中将α晶状体聚集体用高浓度变性剂打散,再降低变性剂浓度,研究单体逐步组装成聚集体的过程。研究发现最先成核的结构总是十几个单纯由αA单体形成的疏水核,然后逐渐添加形成第二层和第三层结构。由此提出的模型是:内核含10—16个αA单体;中间层24个单体,αA和αB的比例为4:1;最外层含24个单体,αA和αB比例为1:1 (图2) 。由于αB更加亲水,可见在该模型中亲水性是由外到内逐渐减弱的[11]。
图2 由玻璃珠搭建的α晶状体聚集体的结构模型。蓝色玻璃球代表αB单体,透明玻璃球代表αA单体
构成α晶状体单体蛋白的二级结构大部分为β折叠。沿肽链的延伸方向,按其折叠次序可以依次分为9个β片层结构 (β1-β9)。当两个α晶状体蛋白单体形成二聚体时,以其中一个单体的β6-β7片层和另一个单体的β6-β7片层结合,构成了反平行β折叠结合界面,将两个单体连接成为二聚体结构。除β6-β7片层结合外,还存在4个分子间的氢键作用,如图3所示的两对R80 (精氨酸)—D107 (谷氨酸) 和R120 (精氨酸) —D109 (天冬氨酸) 间形成的氨基酸分子间氢键[12]。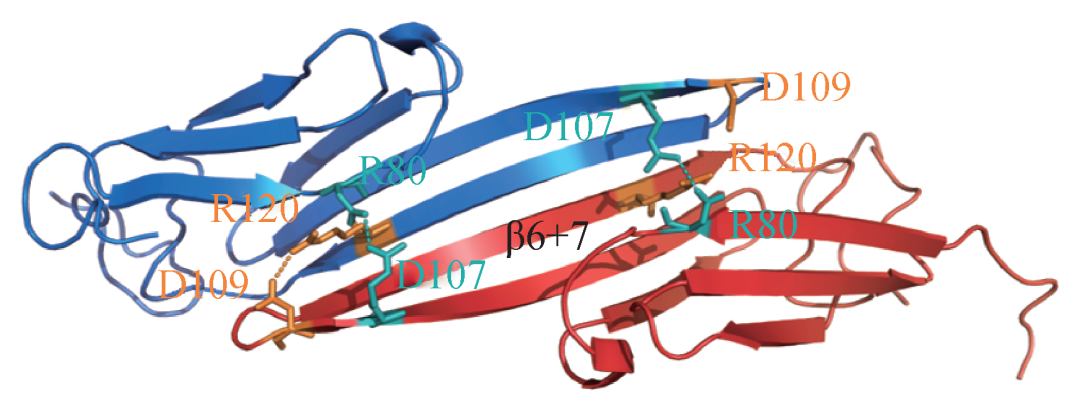
图3 人眼αB晶状体蛋白二聚体结构示意图。β6+7表示单体的β6-β7参与形成二聚体的结合界面,虚线表示分子间氢键
我们的热力学研究表明,最外层的α晶状体单体从聚集体上脱落是一个吸热过程,解离能∆H=46.6 ± 2.8 kcal·mol-1;内层单体的解离能∆H=48.6 ± 0.9 kcal·mol-1;而界面分子间氢键的总解离能为22.6 ± 0.9 kcal·mol-1,折合成单个分子间氢键的解离能为5.6 kcal·mol-1,和文献中分子间氢键能4.7 kcal·mol-1相符[13]。
可见,构成α晶状体界面结合能的分子间氢键及β片层结合能约各占一半。如果以熟知的C-C单键断裂能82.9 kcal·mol-1作为参考,单个分子间氢键能约为C-C单键断裂能的二十分之一,而β片层结合能也主要来自于氢键的结合。可见总的界面结合能相当于10个分子间的氢键键能,而断裂一个分子间的氢键只需要断裂C-C单键1/20的能量。我们可以把α晶状体界面结构看成一个双层氢键构成的拉链,从拉链的横向拉断结合面所需的能量约为C-C单键键能的一半,而顺着拉链方向每次只需打开一个拉链扣,所需能量约为C-C单键的1/20,由此各个击破,起到四两拨千斤的功效。这也就说明为什么多聚体结构是热力学不稳定的、温度高于4℃就会发生单体脱落的原因。另一方面,拉链式结合模式有利于通过较小的温度变化来调节聚集体与单体之间的动态平衡。
04、热休克蛋白:温度调控的蛋白质分子伴侣
核酸是一类生物聚合物,是脱氧核糖核酸(DNA)和核糖核酸 (RNA) 的总称。DNA以双螺旋的形式稳定存在,是记录和存储生命密码的物质载体。RNA以单链存在,容易被降解。尽管RNA可以脱离DNA而单独存在 (如病毒),通常情况下是DNA将合成蛋白质的编码信息转移给RNA,再由RNA负责将遗传指令传送给核糖体进行氨基酸多肽序列 (新生肽) 的合成。新生的多肽链还不能被称作为蛋白质,必须折叠成特定空间结构、并能够行使生物学功能时,才称得上是一个成熟的蛋白质分子。
在生物体内,无论是新生肽链还是蛋白质分子,都可能面临着错误折叠或聚集的风险,这种错误结构的累加会对细胞内动态平衡造成严重破坏,引发诸如衰老、疾病甚至死亡等后果。为了抵御这种威胁,细胞在进化过程中发展出了一套复杂而有效的蛋白质质量控制系统。质量控制系统包括两类蛋白质,即分子伴侣和蛋白酶。分子伴侣的功能是抑制其底物蛋白质的聚集并帮助错误折叠的底物肽链重新折叠成具有活性结构的蛋白质。有些新生肽链合成之后要被转运到细胞膜,中间过程会遇到导致新生肽降解的恶劣环境,如高酸性区域等。这时分子伴侣就会将新生肽保护起来,穿过环境恶劣地段,到达安全的目的地之后再释放,并协助其折叠成正确的空间结构。如果肽链被折叠成错误的结构,或者蛋白质损伤后发生聚集,那么蛋白酶就会将其进行降解,实现纠错和消除隐患的目的,降解后氨基酸仍然可以被核糖体重新利用。
热休克蛋白是生物体内最古老的分子之一,是一种保护性蛋白,当细胞受到高温等恶劣环境袭击时,就会被大量合成,从而帮助每个细胞维持正常的生理活动。热休克蛋白主要作为分子伴侣而参与蛋白质的折叠、转运及组装等过程,能恢复或加速清除细胞内已变性的蛋白质而稳定细胞结构[14]。α晶状体蛋白就属于小热休克蛋白家族,具有分子伴侣活性,能在晶状体细胞内高蛋白浓度的环境下,帮助其他蛋白质正确折叠,防止它们错误折叠及形成聚集体而导致白内障。尽管白内障的成因远比这复杂得多,有一种白内障成因认为,由于晶状体纤维细胞缺乏蛋白质合成及对变性蛋白的清除机制,在漫长的生命过程中,具有聚集倾向的受损蛋白质不断累积,逐渐耗尽自由状态的α晶状体蛋白。当晶状体内没有自由的分子伴侣时,蛋白质聚集过程就发生了,并最终导致白内障[15]。
热休克蛋白译自英文“heat shock protein”。“休克”一词来源于英文单词shock的直接音译。《词源》在“休克”这一条目下给出的解释是:医学上指末梢循环急性衰竭的情况,英语shock的音译。“休克”一词汉化太成功,以致不做一番考据很难发现是英语的音译。英文shock有多种含义:名词有“震惊、震动、打击”的意思;动词含“使震惊、使震动、使受电击”的意思。可见热休克蛋白更准确的翻译应该是 (功能依赖) 热激活的蛋白,可简称为热激活蛋白。
05、光氧化损伤是个意外:γ晶状体的结构与紫外损伤
太阳光的可见光光谱依照波长从长到短的排列次序为赤、橙、黄、绿、青、蓝、紫,又根据其生物效应的不同,将紫外线(UV)部分按照波长划分为四个波段:UVA、UVB、UVC和UVD。UVC波段波长为200—275 nm;UVD为100—200 nm,又称为真空紫外线。UVC和UCD波长较短,在大气中就已经被臭氧层吸收、散射,几乎无法到达地面。UVA波长为320—420 nm,98%以上能穿透臭氧层和云层到达地球表面。UVA可以直达肌肤的真皮层,破坏弹性纤维和胶原蛋白纤维,将皮肤晒黑。UVB波长为275—320 nm,具有中等穿透力,其中波长较短的部分会被眼睛的透明玻璃体吸收,也是造成晶状体紫外损伤的波段。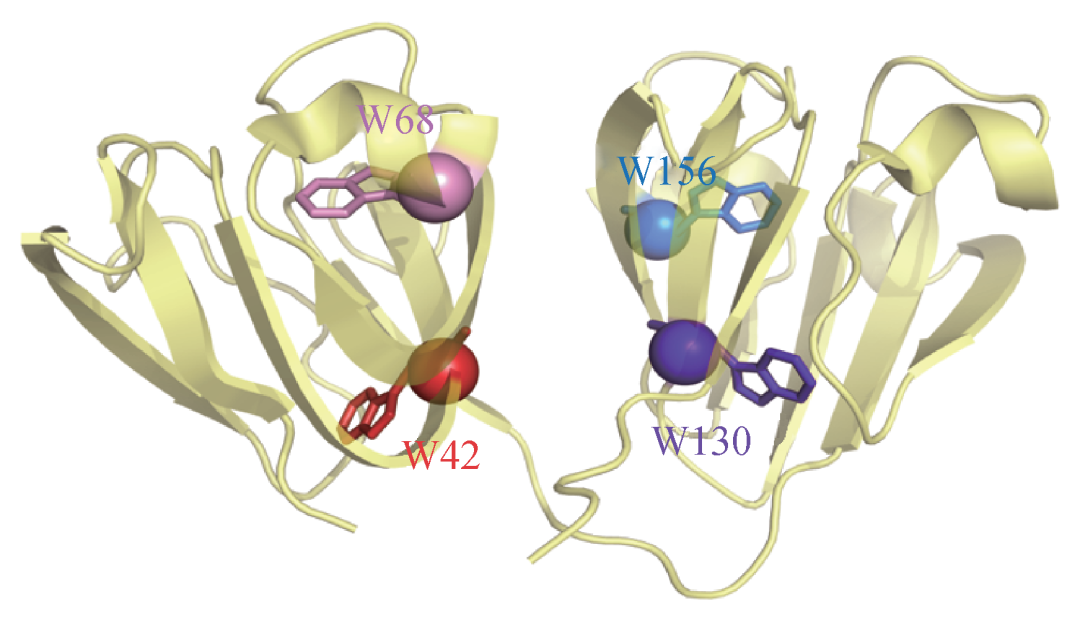
图4 人眼γD晶状体蛋白质晶体结构示意图(蛋白质数据库编码1HK0),W表示色氨酸(Trp)。色氨酸42和68在N端,156和130在C端
γD晶状体蛋白以单体的形式存在于晶体的内核,且含量很高,分子结构在进化过程中高度保守。其热力学稳定性依赖于四个保守的色氨酸 (W或Trp) 残基 (图4) [16]。在正常情况下当紫外线到达晶状体时,一对近邻色氨酸 (紫外吸收峰值280 nm) 间可以通过快速的能量转移,即W42→W68和W130→W156,将光能转化为热能,从而避免蛋白质分子发生光化学反应。这一保守的结构使得γD晶状体蛋白具有天然的抗紫外辐照损伤的功能。
然而,持续的紫外辐照依旧会导致肽链发生光化学裂解或构像变化,这一光损伤过程需要有活性氧的参与。体外实验表明,在相同的UVB辐照条件下,α晶状体蛋白水溶液透明度几乎不会发生改变,而γD晶状体蛋白的浑浊度明显增大。这可归结于紫外辐照损伤导致的蛋白质聚集效应,其中部分聚集过程可以是通过共价键链接的,如二硫键的形成。光诱导的蛋白质聚集过程需要氧气的参与 (图5),并且其聚集程度依赖于蛋白质的浓度和辐照剂量[17]。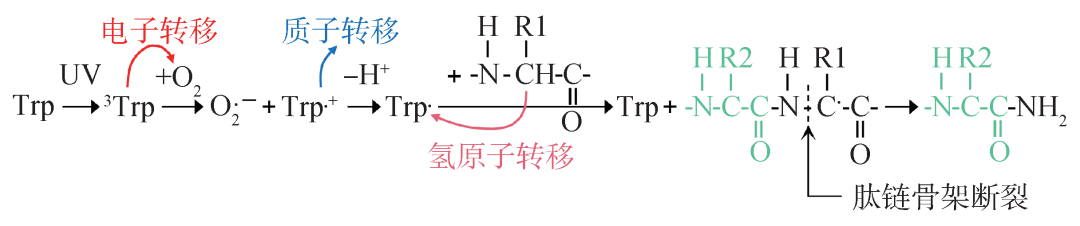
图5 紫外辐照下γD晶状体蛋白由色氨酸(Trp)及O2引发的肽链裂解途径示意图。其中上标小圆点代表自由基
06、断尾求生——γ晶状体被保护的代价
实验中,α晶状体水溶液在温度为25—65℃区间内经325 nm激光辐照后,透明度几乎不受温度影响。而在相同条件下,紫外辐照后的γ晶状体浑浊度与温度呈线性关系。当把α晶状体和γ晶状体按一定比例混合后,在同样条件下,浑浊度一开始在低温区略有增加,然后从35℃开始浑浊度持续变小,直到55℃左右浑浊度达到极小值。随着温度的进一步升高,浑浊度又开始随温度的升高而增大。上述体外实验表明,α晶状体约在高于35℃的温度下才发挥分子伴侣的功能。也就是说,在人体的正常温度37℃下,α晶状体已经发挥功能了。为了确定其分子伴侣的活性,至少还要对一些未知的问题进行解答:
(1) 在升温过程中,由于α晶状体高级结构的变化,紫外损伤后的γ晶状体是和α晶状体原有的疏水界面相结合还是和升温诱导新鲜剥离出来的疏水界面相结合?
实验中采用了一种疏水界面荧光探针分子,该探针分子和疏水界面结合后荧光量子效率增加。将该探针分子和α晶状体混合后升温,发现荧光强度的增加几乎和温度呈线性关系,从而证明γ晶状体应该是和α晶状体新鲜剥离出的疏水界面相结合的。
(2) 紫外损伤γ晶状体有没有结合到α晶状体上去?
在40℃条件下分别利用原子力显微镜和动态光散射测量仪,观测紫外辐照后α晶状体和γ晶状体混合液中α晶状体聚集体的体积变化。两种方法都证明,α晶状体的体积都比无辐射条件下的体积有所增加,从而证明辐射损伤γ晶状体能够和α晶状体相结合。
(3) 与α晶状体结合的γ晶状体的损伤状况?
通过液相色谱分离出αγ结合体,并通过质谱分析发现,结合状态的γ晶状体蛋白在亲水的C端Ala158位点发生共价键断裂,掉下一段含15个氨基酸的肽链(图5)。
(4) γ晶状体蛋白断键是如何发生的?
我们同样对没有加α晶状体的紫外辐照后的γ晶状体蛋白沉淀物进行质谱分析,并没有发现γ晶状体聚集体中存在γ晶状体共价键断裂的现象。由此可以推断,紫外辐照损伤导致γ晶状体蛋白发生构像变化,如果不被α晶状体结合,则会发生聚沉;而被α晶状体结合保护后,会发生C端的短肽链被紫外光进一步裂解。真可谓是天下没有免费的午餐!
07、手拉手的启示:氨基酸/蛋白质分子间氢键
α晶状体聚集体解离过程研究的一个重要切入点是氨基酸分子间氢键的指认。氨基酸分子间氢键的指认是多年前一朵偶然漂进脑海的浪花。孩子上小学4年级时对素描感兴趣,2007年5月的一个周末,送她到西城区丰盛胡同一个四合院内的少年宫学画画,我自己就在侧屋的托儿所内等着。托儿所内全是小桌子、小椅子,完全是一个小人国的世界。坐在小朋友的椅子上,打开手提电脑分析一组氨基酸在重水(D2O)中的脉冲升温时间分辨红外光谱。数据显示在低温下(10℃)羧基(-COO-)的反对称伸缩振动峰不是出现在1620 cm-1,而是在更低频率的1604 cm-1处。
当温度由10℃阶跃到20℃时,该吸收峰蓝移到1620 cm-1,响应时间约30 ns,和仪器的时间分辨20 ns (激光加热过程) 十分接近。可以说这一变化过程几乎是和加热过程同步的。那么这一变化到底对应的是什么物理过程呢?
在这之前,关于这组数据已经和学生讨论过好多回了,就是没有参透。也许是小人国的世界帮了忙,脑海中浮现出一幕小朋友们手拉手的画面。如果氨基酸带正电荷的-NH3+和带负电的-COO-分别代表小朋友的左右手,那么手拉手的小朋友不就暗示了氨基酸在溶液中通过相邻分子的-NH3+和-COO-基团形成分子间氢键,从而在溶液中构筑了一条条分子链吗?-COO-的吸收峰也相应地红移到1604 cm-1处。
而当分子间氢键被热脉冲打断时,-COO-恢复到正常的反对称伸缩振动峰位 (1620 cm-1)。有了这个想法后不久,1604 cm-1峰位就被指认为氨基酸分子间氢键。之后不久论文就发表在国内期刊Chinese Journal of Chemical Physics上[18]。没想到这个不起眼的工作居然在十多年后成为解析α晶状体动态结构的钥匙。直至现在用Google对“氨基酸分子间氢键红外光谱”进行搜索得的少数几篇文章里,这个工作还是最早的。
然而,要令人彻底信服,光有浪花还是不够的,还需要有更多的实验事实来支持。α晶状体动态结构的分子间氢键的实验验证为上述工作提供了一个坚实的支撑。
08、如切如磋,如琢如磨:再议分子间氢键
个人的学识总归是有限的,尤其是在陌生的领域。一个好的发表出来的工作,往往是作者和高水平审稿人通力合作的结晶。一个人武功再高也无法只手拽住自己的头发往天上窜。要完成这一高度必需有外力的介入,打破认识的局限,激发个人的潜能。
记得有位审稿人对工作相当认可,不满意的是这些重要的结论十分依赖于对氨基酸分子间氢键1604 cm-1 (溶剂为D2O) 峰的指认,而该指认仅有一篇参考文献 (而且还是发表在国内、来自于自己课题组的工作),大有将高楼盖在沙丘上的感觉,基础不够夯实。在补充了能够查到的少数几篇文献后改投了现在这个杂志。四个审稿人中有三个表示,该指认还是不足以令人信服。解铃还须系铃人,分子间氢键的红外光谱指认还要从氢键的本质入手。
如果是分子间氢键维系着α晶状体聚集体,那么就可以通过把-COO-在酸性条件下质子化,变成不带电的-COOH,分子间的氢键就被彻底破坏,α晶状体聚集体也会散架成单体,对应的分子间氢键的红外光谱也随之消失。在准备做实验之前进行了文献检索,发现不同酸度下α晶状体的红外光谱已经有报道了,不出所料,当pH从碱性的8逐步变到4时,在H2O中和分子间氢键对应的红外光谱1610 cm-1吸收峰一直存在。当pH降到2.2时,聚集体彻底散架,1610 cm-1吸收峰也随之消失 (由于同位素质量效应,蛋白质酰胺I带的红外吸收光谱峰位在D2O中相对于其在H2O中要红移5—10 cm-1)。
另一方面,如果能够将形成分子间氢键、带负电的-COO-天冬氨酸突变成甘氨酸(侧基为中性的-H),那么结合界面间的分子间氢键就会少一对,相应的1604 cm-1吸收峰强度也会随之降低。这一点也为单点突变样品 (D107G) 所证实。至此,1604 cm-1吸收峰来之于分子间氢键吸收这一光谱指认就被牢牢地坐实了。
09、聚散两依依:α晶状体的动态结构
“实验科学研究过程中,似乎有条不成文的规律:被研究客观事物的复杂程度乘以研究手段的复杂程度等于常数。可见,越是复杂的体系,要求所用的方法要尽量简单;反之手段越复杂,所选的研究体系应该尽量简单。尽管α晶状体蛋白的分子伴侣活性早在20年前就被发现,但其涉及的分子机制却一直没有被揭示。难点之一是在室温条件下,α晶状体与其解离成的单体处于一个动态平衡中,目前尚无法获取α晶状体聚集体的X-射线晶体结构以及完整的冷冻电镜结构。红外光谱相比于前两种方法要简单得多,虽然不可能给出精细的结构信息,但是如果能够给出某些关键信息,这对于问题的阶段性认识,也不失为一种有效的方法。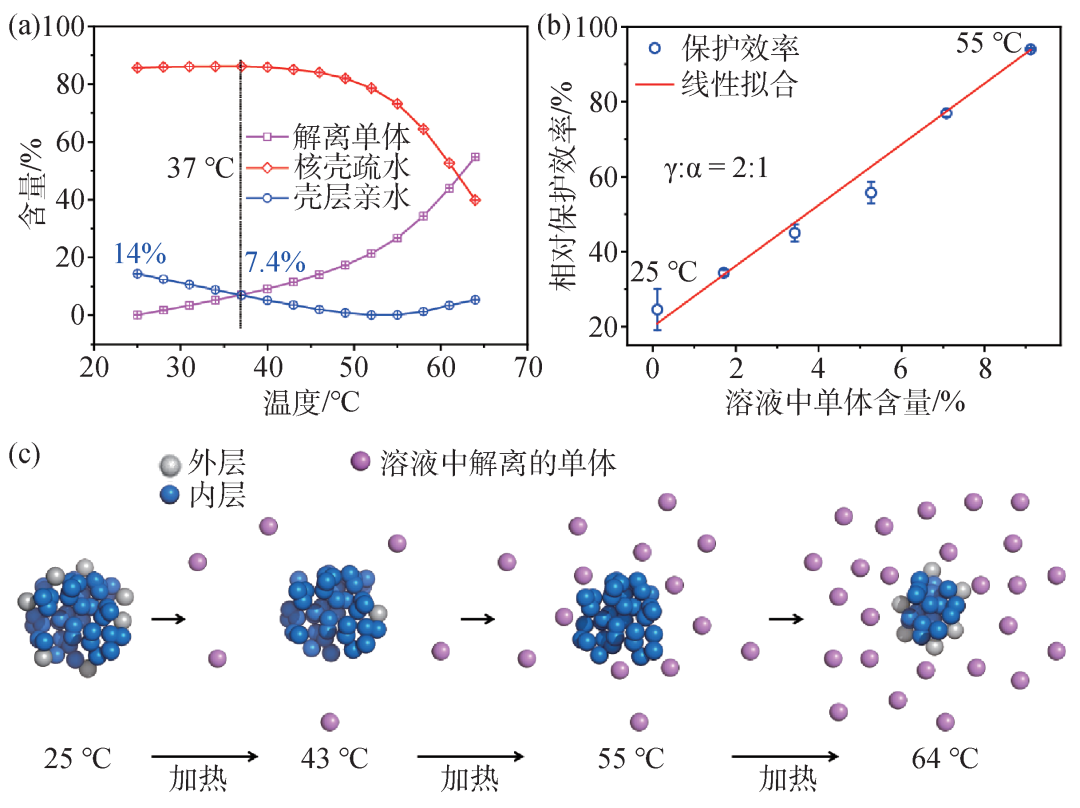
图6 (a) α晶状体变温红外光谱奇异值分解法得到的三种不同亲疏水性组分对应的相对含量随温度的变化。图中圆圈表示表面亲水单体,方块表示解离到溶液中的单体,菱形表示疏水单体;(b)变温条件下α晶状体解离到溶液中单体的相对含量与其对紫外光损伤 γ晶状体的保护效率呈线性关系;(c)由变温红外光谱得出的不同温度下α晶状体解离途径示意图
依据先前的工作,很自然地就把1604 cm-1红外吸收峰归属于聚体中单体间结合界面处的分子间氢键,并作为α晶状体热诱导解聚成单体过程的光谱指针。另一方面,对于变温红外光谱进行奇异值分解 (single value decomposition),可获得与物种相对应的三个独立组分,以及它们的布居数随温度的变化曲线(图6(a))。三个组分具有不同的亲疏水性及热力学稳定性:升温过程中最先解离的是聚集体表面的最亲水组分,高温才开始解离疏水组分。
两者分别解离到溶液中的都是次亲水组分,其中温度低于43℃时,溶液中的单体几乎全部来着于最外层的亲水组分,高于43℃时内层单体才开始解离 (图6(c))。由此提出α晶状体的核—壳模型:壳层包含最亲水的组分 (单体),核心包含最疏水的组分,而溶液中单体是从壳层和核表面层解离出来的。可见由光谱获得的模型与生物学家提出的疏水性呈梯度分布的三层核壳层模型一致:内核最疏水,第二层次之,最外层最亲水。不同的是光谱模型将内核和第二层合并为核壳结构的核心层。光谱模型给出α晶状体聚集体外层亲水单体的总含量是14%,37℃时从α晶状体聚集体解离到溶液中的单体含量为7.4%,而40℃时解离到溶液中的单体含量为9.2%。
国外科学家利用速率沉降法将解离的单体和残缺的α晶状体聚集体进行物理分离,分别获得在7℃、25℃和37℃时解离成单体的含量。其中37℃时为8.7%,外推到40℃时解离单体的含量为10.8%。可见由变温红外光谱解析到的不同温度条件下解离到溶液中单体的含量和生物学实验直接测量结果定量符合。实验进一步表明,解离成单体的含量与其对紫外光损伤γ晶状体的保护效率呈线性关系 (图6(b))。
依据上述α晶状体聚集体的结构,可以预见在热解离过程中分子间氢键断裂数和解离到溶液中的单体含量呈线性正相关,实验结果也支持这一推论。
10、失去自由的分子伴侣:α晶状体保护紫外辐照损伤γ晶状体蛋白的机制
早期文献提出,受损伤的γ晶状体如果没有被溶液中α晶状体单体抓住形成αγ二聚体的话,就会形成γ晶状体聚集体。并且一个α晶状体聚集体可以结合多达7个γ晶状体蛋白单体。如果假定α晶状体聚集体由50个单体聚集而成,按照光谱模型,最外层亲水单体占有的比例为14%,即7个单体。也就是说在生理温度条件下,最多只有7个α晶状体单体可以和γ晶状体单体结合。光谱模型又一次和生物学实验定量吻合[19]。进一步地热力学分析表明,在温度为35—55℃温度区间,αγ二聚体与部分解离的α晶状体聚集体的结合能约为∆H = - 30 kcal·mol-1,是一个放热过程,基本上可认为是一个热力学自发过程。可见,一旦形成αγ二聚体,该二聚体就会以热力学自发的形式组装到部分解离的α晶状体聚集体上,实现对紫外损伤γ晶状体的保护功能,如图7所示。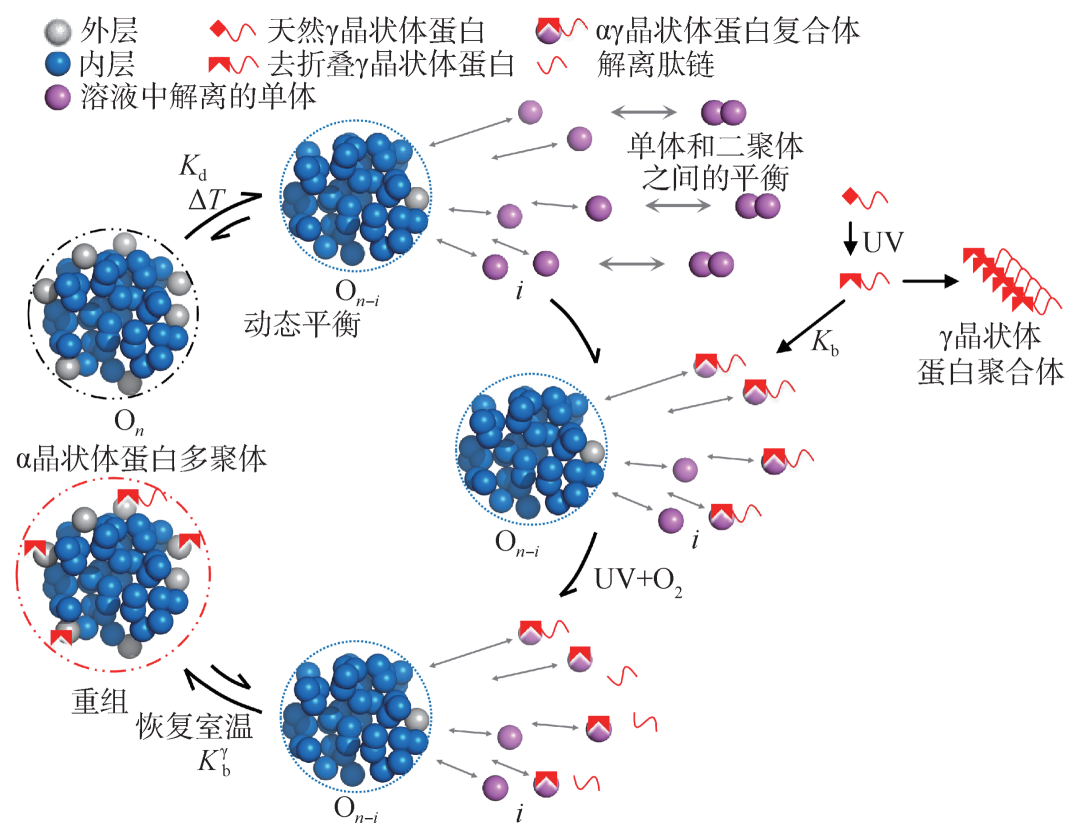
图7 热诱导下α晶状体蛋白分子伴侣活性的机制示意图。该机制发生的温度区间是25—43℃,涉及聚集体/单体动态平衡(Kd为平衡常数);α晶状体单体与γD晶状体单体间结合(平衡常数为Kb)及αγ二聚体结合到部分解聚的α晶状体(On-i)上(Kbγ为平衡常数)
在生理温度条件下 (37℃),能够从α晶状体最外层解离到溶液中的自由单体只有7.4%×50≈4个,可以和光损伤的γ晶状体结合。一旦结合后,就自发地组装到α晶状体聚集体表面。一旦外层表面所有的7个最亲水单体都被紫外损伤的γ晶状体结合后,整个α晶状体聚集体就会失去对损伤的γ晶状体提供进一步保护的能力,同时水溶性也随之降低。
11、激活存量,再护一程
每个α晶状体表面能够参与保护功能的亲水单体总共有7个,其中4个在37°C生理温度条件下已经被激活。如果这4个自由单体都与受损伤的γ晶状体结合,并被绑定在α晶状体表面,那么这个α晶状体在生理条件下就不再具有伴侣分子的保护作用。国外研究者提出了α晶状体保护功能随年龄增长趋于饱和的假说,如图8所示。图中γ晶状体在紫外光辐照下发生肽链截断、脱氨基作用或者形成共价链接等损伤后,形成部分去折叠形态(I*)。对于年轻人,α晶状体尚具有足够的保护作用,去折叠状态的γ晶状体与α晶状体形成复合体,阻止了γ晶状体聚集体形成(图中的绿色通道);对于中老年人,α晶状体的保护功能趋于饱和,失去了与去折叠状态的γ晶状体的结合能力,后者最终形成聚集体而导致白内障(图中的橙色通道)[15]。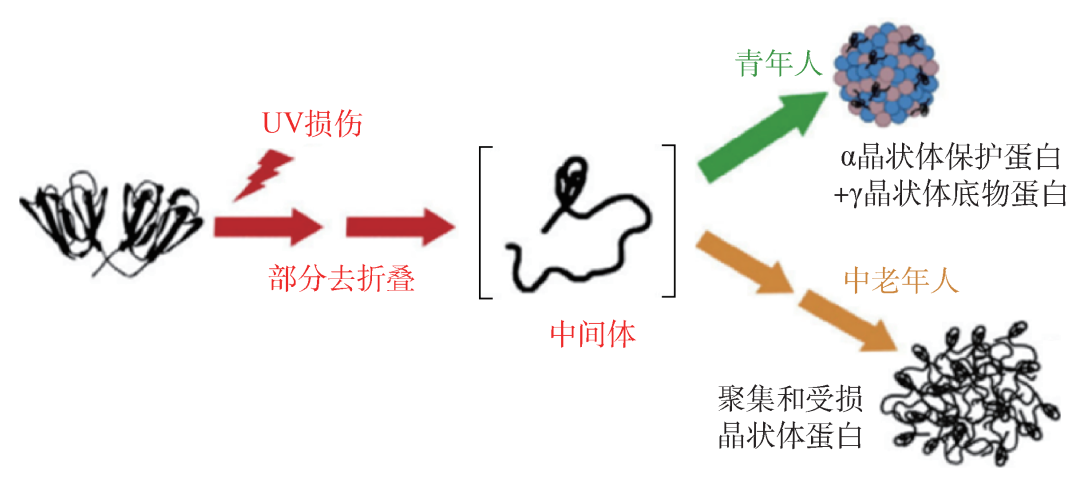 图8 人眼部分折叠γ晶状体被α晶状体伴侣蛋白识别及绑定的路径
图8 人眼部分折叠γ晶状体被α晶状体伴侣蛋白识别及绑定的路径
可见上述假说与我们得出的α晶状体蛋白对紫外损伤γ晶状体蛋白具有有限保护能力的结论不谋而合。在生理温度条件下,饱和保护容量占总容量的57%,另外43%的容量只能在高于生理温度条件下才有可能逐步释放。由此奠定了通过热激活提高α晶状体蛋白保护容量之饱和阈值的科学基础。
12、朋友来了有好茶
行文至此,我想读者已经窥见了“茶可以起到明目的作用,一定要选择一个刚刚泡好的茶或者是热茶”的奥秘了。原来其科学道理就承载于α晶状体热休克蛋白的功能当中。生命之初,晶状体蛋白水溶性很好,尽管蛋白质浓度很高,依然能够做到水“乳”交融,并且也还没有损伤的蛋白漂浮于晶状体内,如刚涌出的泉水,清澈透明。正如在文学作品中,大都用“水汪汪”、“水灵灵”这样的字眼来描写孩子们一双清澈的眼睛。而对于上了岁数的人的双眼,则毫不掩饰地用“昏花、浑浊”等字眼来形容。虽然有点残酷,的确也是命运的写照。
从人之初的“水灵灵”到饱经沧桑后的“混浊”,双眼经历了无数个阳光灿烂的日子,晶状体蛋白也蒙受了紫外辐照和氧化损伤的联手暗害,让原本亲水的α晶状体表面附上了伤残“断尾”、疏水的γ晶状体。随着外层可用的亲水α晶状体单体越用越少,α晶状体表面的伤残蛋白越来越多,再也无法派出自由的α晶状体单体,去保护新近损伤的γ晶状体。
可见人眼晶状体貌似不可逆地由清澈变成混浊,最后再发展成白内障。然而造化的设计并不完全是这样的,我们的研究带来一个令人鼓舞的讯息,那就是当眼睛开始走向混浊的时候,α晶状体表面的外层还有43%的自由亲水单体没有被消耗掉,只要在一定安全的范围内给眼睛升温,就有可能让开始混浊的眼睛变得更清澈一些,延缓白内障的发生。这一方法尤其对中老年人适用,这也是老祖宗总结出的茶叶明目的奥秘。
国人开门七件事“柴米油盐酱醋茶”,就连嗜辣如命的云贵川湘的同胞也没有把茶替换成辣,足见茶道深入人心。科学昌明的今天,茶道只有拥有了坚实的物质科学基础后,才可谓之为道。
最后我们可以依据晶状体紫外损伤及保护机制,提出如下原则性建议:
(1) 尽量避免紫外光对人眼的直接照射 (比如戴墨镜);
(2) 提高晶状体内在环境的抗氧化能力;
(3) 到了一定年龄后,适当用热的水汽熏眼睛 (温度舒适为宜,喝热茶只是顺便实现了这一功能)。
13、后 记
本文初稿完成后请同事窦硕星教授帮忙审阅文字及科学表达的准确性。窦老师的办公室就在我的斜对面。平时交流很多,几乎是我这几年来研究工作中各种想法的第一个倾听者和批评者,对我们组开展的研究工作十分了解,自然也包括这项工作。出乎意料的是,窦老师读完全文,激动地跟远在山东沂蒙、八十岁的母亲打电话,建议她用热茶熏蒸眼睛,还说他一个同事把这个做法的科学道理研究明白了。没想到,老人家非常平静地说:“不一定要用热茶,热水也行。你老姥娘 (母亲的奶奶) 原先一直就是用热水熏眼睛的,活到八十八岁,眼睛还好好的。”
不得不佩服,高人在民间!早上见到窦老师在认真地涮洗茶杯,失传多年的家传又开始延续了。
参考文献
[1] 梁丽 . 生物化学与生物物理进展,2017,44:11
[2] Li H,Yu Y,Ruan M et al. Biophys. J.,2022,121:2233[3] Horwitz J. Exp. Eye Res.,2003,76:145[4] 林宁钦,姚克,陈祥军 . 高等学校化学学报,2021,42(11):3379[5] Bloemendal H,Hockwin O. Crit. Rev.Biochem. & Mol. Biol.,1982,12:1[6] Mathias R T,Kistler J. J. Membr Biol.,2007,216:1[7] Truscott R J. Exp. Eye Res.,2005,80:709[8] 鲍永珍,曹晓光,黎晓新 等. 中华医学杂志,2009,89:4[9] Reddy G B,Das K P,Petrash J M et al. J.Biol. Chem.,2000,275:4565[10] Santhanagopalan I,Degiacomi M T,Shepherd D A et al. J. Biol. Chem.,2018,293:19511[11] Walsh M T,Sen A C,Chakrabarti B. J.Biol. Chem.,1991,266:20079[12] Jehle S,van Rossum B,Stout J R et al.J. Mol. Biol.,2009,385:1481[13] Davis A M,Teague S J. Angew. . Ed.,1999,38 (6):737[14] Wickner S,Maurizi M R,Gottesman ,1999,286:1888[15] Acosta-Sampson L,King J. J. Mol.Biol.,2010,401:134[16] Basak A,Bateman O,Slingsby C et al. J. Mol. Biol.,2003,328:1137[17] Schafheimer N ,King J. Photochem. Photobiol.,2013,89:1106[18] Ye M,Li H,Zhang Q et al. Chin. J. Chem. Phys.,2007,20:461[19] Palmieri V,Maulucci G,Maiorana A et al. Chem. Bio. Chem.,2013,14:2362
本文经授权转载自微信公众号“中国物理学会期刊网”,原题目为《“喝热茶明目”——经验之谈背后的科学机制》。
0
推荐




 京公网安备 11010502034662号
京公网安备 11010502034662号 