本文希望从物理而非历史发展的角度,用极简的逻辑梳理绝对温度和熵的一些基本关系,强调温熵共轭的深刻性、基本性和对称美。
撰文 | 刘全慧(湖南大学物理与微电子科学学院 理论物理研究所)
来源 | 选自《物理》2023年第8期
01
“绝对温度和熵是同时定义的”
2004年12月初,中国物理学会教学委员会在清华大学物理系召开了一次扩大会议。当时,杨振宁先生在清华大学讲授大学物理课程,讲到了热力学第二定律,使用的教材是D. Halliday,R. Resnick,J. Walker所著Fundamentals of Physics 第六版。会议不但组织与会者旁听杨先生的授课,还邀请先生作了一场教学研究报告。
在报告中,杨先生对所用教材进行了若干点评。他说:“热力学第二定律是物理学历史上的一件大事情,其中的逻辑,比如说绝对温度的定义和熵的定义,是19世纪物理学家经过了几十年才弄清楚了的。可是Halliday和Resnick的书中没有与此有关的内容,absolute temperature这几个字好像就是一笔带过了,我想这是一个很大的错误。这对于一个随随便便的学生来讲无所谓,可是我想对于清华的学生来讲是不好的”[1]。我当时就在现场,听到杨先生的这段话,如雷贯耳。我立即领悟到卡拉氏(Carathéodory)引入熵函数时的意义:用同一个微分方程同时定义了两个量,即绝对温度和熵。因此,这一感悟和杨先生的评论之间产生了强烈共鸣,共鸣的一个理性结果是内化。在我的记忆里成为一个命题,一个断言,一个警句:“绝对温度和熵是同时定义的”。然后,我把这句话当成了杨先生的话发表到了《物理与工程》上[2],并多次宣扬这一“杨先生的观点”[3]。
聆听杨先生的这场报告已是近20年前的事了,最近才和杨先生报告的原始录像进行比照,发现杨先生没有说过“绝对温度和熵是同时定义的”,也没有说过类似的话。这句话是我个人对杨先生观点的认识和感悟。此后每次读到热力学相关部分时,都会想到这一“杨先生的观点”。绝对温度和熵引入到热力学的同时性,使得熵具有某种性质,绝对温度也有对应的性质;反之亦然。
在热力学的内能表象中,绝对温度和熵共轭,简称温熵共轭。但是,这个表述看似没有实质内容。也许正是这种表述的“空洞性”,导致了Halliday和Resnick的重熵轻温(也许一些老师和学生也持有类似观点)。更何况,热力学还有个熵表象,在这个表象中,能量和温度的倒数共轭,如果温熵共轭,也应该有温能共轭。
本文希望从物理而非历史发展的角度,用极简的逻辑梳理绝对温度和熵的一些基本关系,强调温熵共轭的深刻性、基本性和对称美。本文的主要内容将局限于单元系的热力学,所有符号都取其通常的含义,不一一标注。
02
定义绝对温度和熵的物理和数学
在热力学中引入绝对温度和熵,可以通过物理和数学这两个不同的途径来实现。
首先看物理过程。根据热力学第二定律,可以证明卡诺定理。该定理指出,所有工作在两个给定温度热源之间的可逆热机的效率都相等。这个循环可称为卡诺循环,热机称为卡诺热机。注意,这里的卡诺循环不同于理想气体的卡诺循环。
由于卡诺热机的效率和工作介质的具体性质无关,只能依赖所有工作介质的普适性质或者某种绝对性质。这个绝对性质就是绝对温度T,也称之为绝对温标。可逆热机的效率为
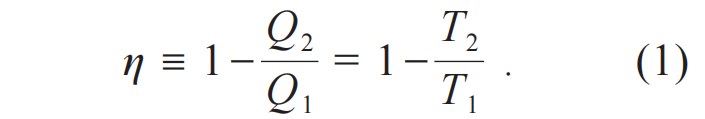
这个结果可以改写为对称的形式
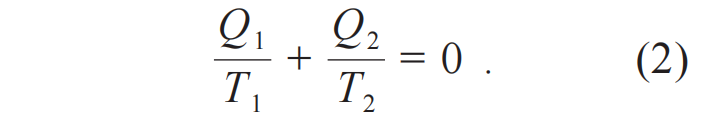
(2)式和(1)式的不同在于,(1)式中的热量Q非负而(2)式中的热量Q为代数量,(2)式规定系统或者热机从热库中吸热为正,系统或者热机对热库放热为负。
如果面对的不是工作在两个热库的卡诺热机,而是一个任意的可逆循环,则可以把这个循环分割成很多个小的卡诺循环,每个小循环中的吸放热量都很小,记为∆Q。反复使用(2)式就得到:
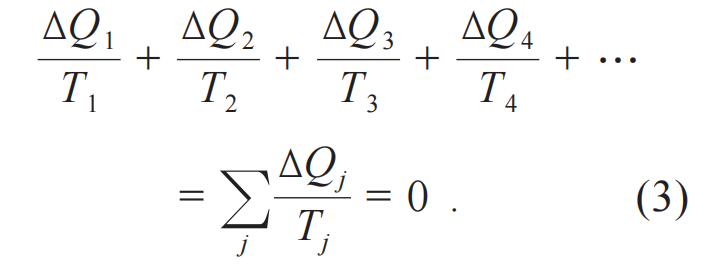
如果每个卡诺循环吸放的热量足够小,可以化求和为积分:
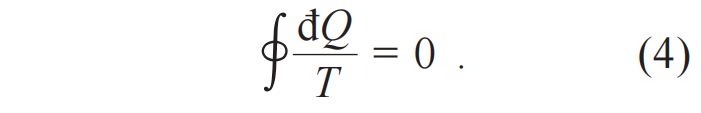
注意,热量的微元đQ不是一个完整微分dQ。物理上,đQ不依赖于状态而依赖于过程。但是,此đQ/T仅仅依赖于状态而不依赖于过程,也就是出现了一个新的状态函数,定义为熵S:
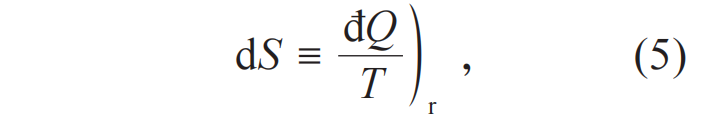
下标r强调了这里讨论的过程都是可逆的。在(5)式中,绝对温度和熵是同时定义的。
数学过程如下。根据热力学第一定律:
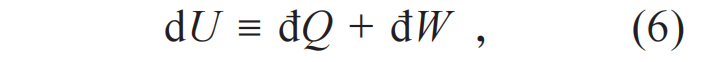
仅仅考虑体积功đW=-pdV,得到如下结果:
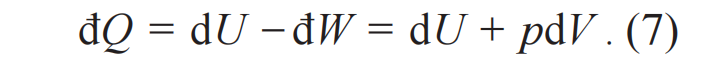
这个公式两边的数学性质不同,左边是过程量的改变,右边是状态量的改变。假设đQ是某个待定函数φ(U , V )和某个新的状态函数Ψ微分的乘积đQ=φdΨ,(7)式成为
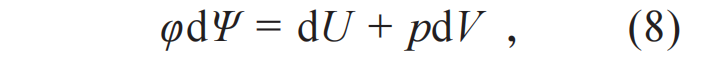
数学上,完整微分dΨ 满足:
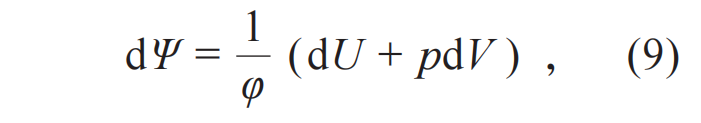
取独立变量为(U, V),Ψ 对这两个变量的二阶微分和(U , V )的次序无关,也就是
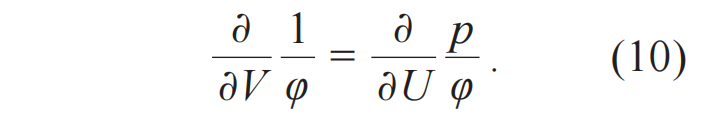
于是,微分方程(9)的解同时引入了绝对温度φ →T 和熵Ψ →S。也就是(5)式的数学基础。
03
等温和等熵过程的不可达到原理
数学上引入绝对温度和熵的过程不会如此简单。因为热力学中常常出现三个以上的自由度,需要更为细致的数学分析。这些数学细节可以在王竹溪先生的教科书[4]中找到。我们关心的是等温和等熵过程的一个共性。
在热力学的发展历史上,卡拉氏注意到,等熵过程有个“缺陷”[5]:热力学系统每一个平衡态的附近,存在另外一个状态,这个状态不能以绝热过程而达到。称之为卡拉氏绝热过程不可达到原理,可以简称为绝热过程不可达到原理。下面,我们把这个原理建立在热力学的基本原理之上。
如果平衡态A可以通过做功和传热到达平衡态B,两个平衡态之间的热力学量满足热力学第一定律,记为

现在希望找到一个绝热过程,连接B和A。由于内能是状态函数,从B返回去到A的话,∆UB→A→-∆UA→B。假设有一个绝热过程连接B和A,∆QB→A=0,外界对系统做功∆WB→A≠-∆WA→B,根据第一定律,(∆U)B→A和∆WB→A之和为零,即
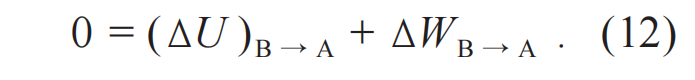
把(11)和(12)两个方程联立起来,进一步得到
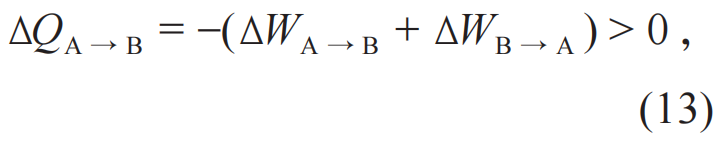
即一个循环完成之后,系统从单一热源吸热全部转换成对外界的功而没有其他变化,这违背了热力学第二定律的开尔文表述。因此,假设不成立。由此可见,绝热不可达到原理是热力学第二定律的开尔文表述的一个等价表述。
与绝热过程不可达到原理对应,还有一个等温过程不可达到原理[5]:热力学系统的每一个平衡态附近,存在另外一个状态,这个状态不能以等温过程而达到。这个原理近乎平庸,这是由于温度可以选为两个平衡态的参量,由于两个温度不同,这两个平衡态就不同。如果和(8)式类似,选(U, V)两个变量作为热力学系统的变量,结论相同。认证过程如下。设一个等温过程是:
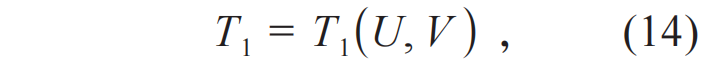
设另外一个等温过程是:
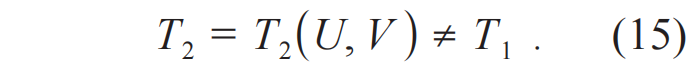
几何上,(14)式和(15)式是(U, V, T)空间中两个不同的曲面,由于T1≠T2,这两个曲面不会相交。即等温过程不可达到原理成立。
04
零温即零熵
热力学第三定律有三种不同表述[4]:能斯特定理、绝对零度不可达到、零点熵为零。
零点熵为零可以表述为零温即零熵,这一点包含在能斯特定理表述中。以两个变量(T, V)的系统为例,能斯特定理的数学形式是:
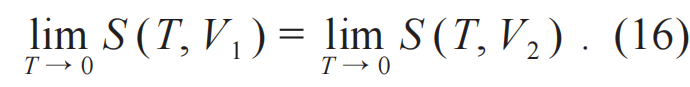
注意到熵就其定义来说是广延量,即
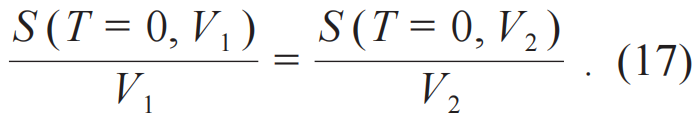
联立(16)和(17)式,唯一非平凡解是
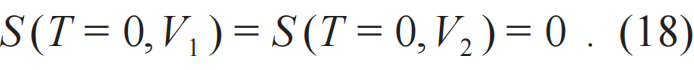
这个方程既是状态方程也是过程方程。从过程方程的角度表述如下:零温时等温过程即绝热过程。这个表述可以看成是能斯特定理的等价表述[6]。同样的道理,零熵即零温。
零熵即零温仅仅适用于低温时单一组分的物质,对于多元系,(17)式不再成立。仅靠(16)式只能得出零温时的熵是一个绝对常数,可以不取零,也可以取零。这个取值任意性说明了热力学第三定律的“缺陷”:需要物质结构的微观理论。
05
统计物理中的熵温关系及其他
具有确定的能量、体积和粒子数(E, V, N)的系统可以称之为简单孤立系统,对这个系统可以定义微观状态数Ω(E, V, N)。这个微观状态数就是数学上的计数,没有赋予物理意义。把这个孤立系统分成若干部分,其中第i 个部分具有如下能量、体积和粒子数(Ei, V, Ni),(i=1,2,3,···),每一部分都可以当成宏观的系统且具有微观状态数Ωi =Ωi (Ei, V, Ni),Ωi 和Ω之间的关系为
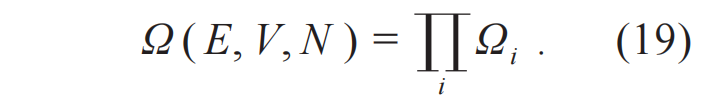
当系统已经到达平衡态,微观状态的数量不再变化,即

由于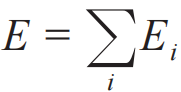 ,可以证明如下数学关系:
,可以证明如下数学关系:
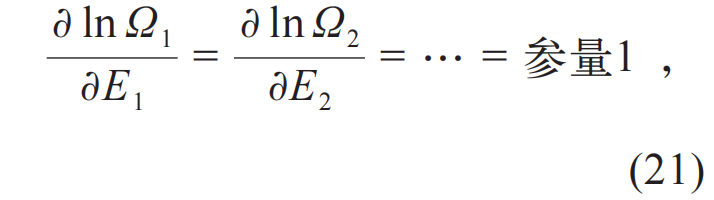
热力学为这个关系提供了物理解释,即同时赋予lnΩi 和参量1的物理意义:

至此,同时引入温度T 和熵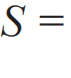
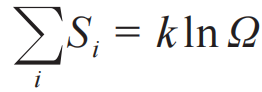 。同时也可以看出,如果Ω是一个数学量,lnΩ 就成了物理量。这一点,在系综理论的其他部分也可以看到,例如对于正则系统,配分函数是一个数学构造,但是取对数并乘上温度之后,就成了物理量自由能,表达式是:F=-kT lnZ。
。同时也可以看出,如果Ω是一个数学量,lnΩ 就成了物理量。这一点,在系综理论的其他部分也可以看到,例如对于正则系统,配分函数是一个数学构造,但是取对数并乘上温度之后,就成了物理量自由能,表达式是:F=-kT lnZ。
这里有三个迷惑:第一,如果没有热力学,从(21)式会回到热力学吗?结论:是。统计物理中有各种结果,例如∂lnΩi /∂Vi =参量2,等等。这些结果需要一个系统化的解释,这个系统化的宏观理论只能是热力学。第二,计算微观状态数Ω(E, V, N)的时候,这里的能量E 取确定数值吗?从经典力学中,能量是连续的,似乎可以取确定的数值。但是,世界是量子的,系统的能量取确定值和微观状态的计数之间,会导致矛盾。这是由于,微观状态的计数要求,每个微观状态占有hr (r 为一个分子自由度的个数)的体积元,N个粒子就占有hNr 相空间体积元。在同一个相空间中,可以定义这个体积元也可以定义具有确定能量的几何面,但是,体积元并非总是在几何面上。可以通过取一个极小而非零的能量壳层∆E 解决这个问题。第三,如果∆E=0,也就是“绝对的”孤立系。这个想象中的孤立系是无法定义温度的。这里的绝对指的是,(20)式中的∂既不能是虚位移也不能是实位移。当我们把一个孤立系分割成为若干小系统的时候,要么是引入了虚位移 (想象上的分割),要么是引入了开系 (实际上的分割),已经不再是理想的孤立系。因此,∆E≠0可能为微正则系综中温度定义的难题提供了解决的途径。也就可以理解在进行分子动力学模拟时,孤立系统需要采取一些特殊的手段,才能引入温度[7]。
06
宇观尺度中的温熵对应
热力学是根据有限时空范围内的实验结果而总结出来的,主要处理宏观对象,能不能推广到整个宇宙,是一个有待研究的问题。即便如此,在确立的黑洞热力学理论中,温熵对应依然有效。
对于只有一根质量毛的施瓦西黑洞,黑洞热力学中的绝对温度TBH和熵SBH只由黑洞质量M 唯一地确定[8]:
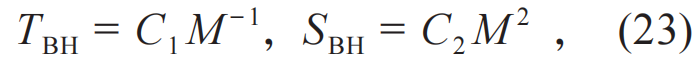
其中C1和C2为一些自然常数的乘积。极限情况下,黑洞热寂(零温TBH→0)和黑洞熵无限大(SBH→∞)对应,也是一种温熵共轭性的体现。
07
结 语
绝对温度和熵之间的对应是一个基本关系,无论熵和绝对温度的定义,还是等温过程与等熵过程之间的相应性;无论零温即零熵,还是黑洞热力学,都可以发现这一对应。在热力学的基本方程中,温熵对应体现为绝对温度和熵是一对共轭量。因此,绝对温度和熵之间对应类似中国文化中阴和阳的对称性,各自以对方为自己存在的前提;熵具有某一性质,绝对温度也有对应性质,反之亦然。
温熵共轭的这种对称性,具有强烈的理性美感,这种美感正是王国维所谓的壮美。感知壮美,需要训练,然后壮美会把人引到更加绚烂的世界里,这就是科学的魅力。
参考文献
[1] 杨振宁. 物理与工程,2005,15(1):2
[2] 刘全慧,陈曙光,姚凌江 . 物理与工程,2007,17(2):49
[3] 刘全慧.物理,2020,49(3):191
[4] 王竹溪 . 热力学(第二版). 北京:北京大学出版社,2005. p.137,p.360
[5] 巴扎洛夫著,沙振舜,张毓冒译 . 热力学(第四版). 北京:高等教育出版社,1988.p.50
[6] Callen Herbert B. Thermodynamics and an Introduction to Thermostatistics(2nd Ed). New York:John Wiley & Sons,1985. p.30,p.278
[7] 郑伟谋. 物理,2018,47(10):617
[8] Hawking S. The Universe in a Nutshell. New York:BantamBooks,2001. p.63
本文经授权转载自微信公众号“中国物理学会期刊网”。
0
推荐




 京公网安备 11010502034662号
京公网安备 11010502034662号 