只有18个月大的先天失聪婴儿,在接受了短短16分钟的基因治疗手术后,逐渐恢复了听力,得以重新聆听世界,回应父母的温柔呼唤。她是全球首位接受基因疗法且获得积极效果的最年幼患者。
今年以来,全球多个研究团队在基因疗法治疗先天性耳聋领域取得亮眼的突破,这预示着全新失聪疗法时代的到来。
撰文 | 小叶
来自英国牛津郡的奥帕尔·桑迪(Opal Sandy)只有18个月大,但出生时就确诊罹患一种罕见的遗传性疾病——听觉神经病变,导致她先天失聪。她还有一个5岁的姐姐,也患有同样的听力障碍,如今佩戴人工耳蜗,已经很好地适应机器辅助下的日常生活。同时,也意味着奥帕尔终生也需要人工耳蜗相伴。[1]
然而,试验性的基因疗法为她打开了通往正常生活的大门,她参加了剑桥大学医学院附属阿登布鲁克医院(Addenbrooke's Hospital)展开的CHORD临床试验,成为了在英国、美国以及西班牙招募的受试者一员。
在短短16分钟的突破性手术过程中,奥帕尔处于全麻状态,她的右耳部被注射入包含有正常拷贝基因的试剂,同时在左耳植入了人工耳蜗。
术后几周内,临床医生注意到在关闭左耳人工耳蜗的情况下,奥帕尔能对声音做出反应,而且随着时间的推移,她的听力持续改善。终于,手术后24周,医生确认她接受基因疗法的右耳能够听到轻柔的声音,如低语声,说明她的听力已经接近正常水平。如今,奥帕尔不仅能听到父母的呼唤,自己还能说出诸如“爸爸”、“再见”之类的简单词语。[2]
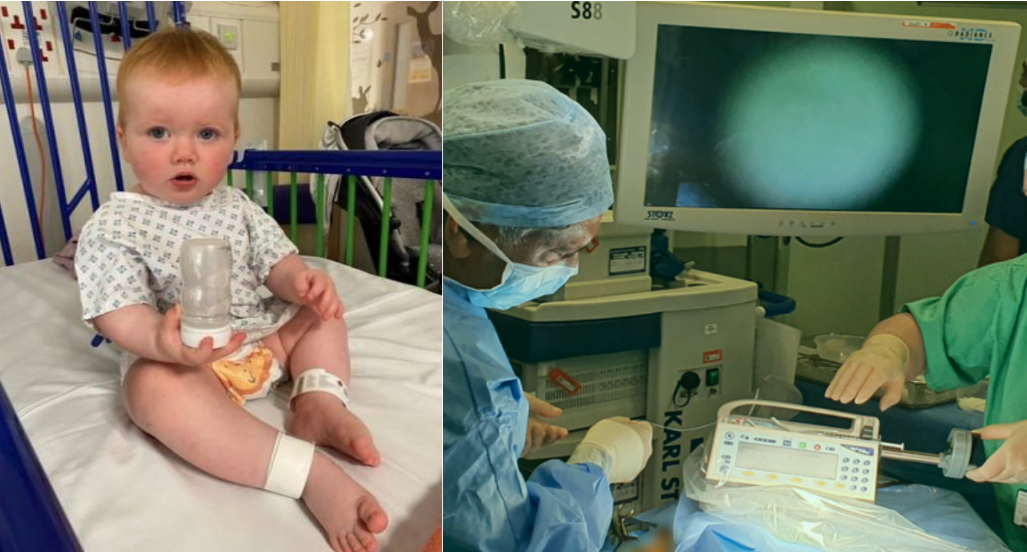
左图:接受手术的奥帕尔;右图:基因试剂注射过程
奥帕尔的母亲欣喜不已:“当奥帕尔第一次不用人工耳蜗就听到我们在鼓掌时,我们都震惊不已,6个月后临床医生团队确认她已经‘接近正常听力’,大家都非常激动。”
而CHORD临床试验的首席研究员、耳科医生马诺哈尔·班斯(Manohar Bance)教授表示,初步结果超出团队预期,这一前沿性基因疗法有可能治愈这种类型的听力障碍患者。“我们已经展开了数十年的研究,这一次终于在人类身上看到了真正让患者受益的效果。”班斯教授补充道。[3]
奥帕尔是全球首位接受基因疗法且获得积极效果的最年幼患者,这项试验不仅标志着基因疗法成功的开始,也预示着全新失聪疗法时代的到来。
基因缺陷导致先天性耳聋
听力损失是人类中最常见的感官障碍症。根据世界卫生组织统计,全球约有4.32亿成年人和3400万名儿童患有致残性听力障碍。尽管导致听力损失的致病原因可能相当多样化,但遗传突变导致的先天性耳聋患者占据了其中70%至75%。先天失聪不仅让儿童从出生之日起便无缘听到世界上的各种美妙声音,也严重阻碍了儿童言语、认知以及智力的发育。[4]
奥帕尔罹患的听觉神经病变由OTOF基因的致病突变所引起,也称为常染色体隐性遗传性耳聋(DFNB9)。OTOF基因编码otoferlin蛋白质,主要参与耳蜗内毛细胞突触囊泡释放神经递质,使得耳朵内的内毛细胞像刷子一样突起弯曲,从而让大脑接受到声音信号。而内毛细胞中耳畸蛋白表达的缺失会导致毛细胞损伤,声音刺激信号因此无法正常传递至听觉神经通路,引起耳聋。据统计,全球约有20万人出生时携带两个有缺陷的基因拷贝,导致先天失聪。[5]
目前临床上相关治疗药物非常稀少,而改善这种听力损失的唯一选择是助听器或人工耳蜗,这些方法相当有益,但也有明显的缺点:无法恢复自然声音感知的重要特征,如在嘈杂环境中的时间处理和频率调谐,往往导致语音识别效果不佳。
随着医学专家从遗传学角度不断深入对致聋基因的了解,基因疗法成为解决听力损失问题的潜在有效方法之一。与此同时,全球专业团队也在积极探索其他替代性疗法,如干细胞和其他分子策略等。
基因疗法有其独特优势
基因治疗旨在替换、抑制或者编辑有缺陷的基因以治疗疾病,由三个主要部分组成:遗传物质、用于基因传递的载体和基因编辑工具。
早在1989年,美国国立卫生研究院就进行了第一次成功的人类细胞核基因转移实验。然而,由于技术尚未成熟,之后出现越来越多的失败甚至死亡事件,让基因疗法一度停止。直到2006年,基因治疗在实验和临床两方面不断取得进展,该领域又恢复了研究活力。如今,医学专家在肿瘤治疗、心血管疾病、传染性疾病、神经退行性疾病以及遗传性疾病多个方面,积极探索基因治疗的可能方案。[6]
具体到治疗遗传性耳聋,基因疗法有其独特优势。首先,耳朵内部的耳蜗在解剖结构上保持独立。此外,血-迷路屏障的存在可防止异常物质进入内耳淋巴液,将其与全身血液循环隔离开来。这些独特特性虽然给内耳药物递送技术带来了不小挑战,但却成为了基因治疗的理想靶点,因为能有效减少潜在的非靶向系统传播风险。其次,治疗载体可以直接输送到耳蜗液体中,可轻松扩散,直达目标细胞类型。因此,在各种基因治疗方法中,使用正常基因拷贝来替换患者体内有缺陷的基因已被广泛用于临床治疗单个基因性听力丧失,包括前文提及的DFNB9。[4]
剑桥大学医院的CHORD试验于2023年5月正式开始。研究人员以改性的无毒腺相关病毒(AAV)作为载体,将OTOF基因的有效拷贝添加入其中制成注射针剂,随后通过输液管将混合物质注射入耳蜗,让有效基因拷贝替换掉患者原本的缺陷基因,从而修复受损的内毛细胞,让它们重新发挥作用,将声音刺激传递至听觉神经通路,让失聪儿童恢复听力。
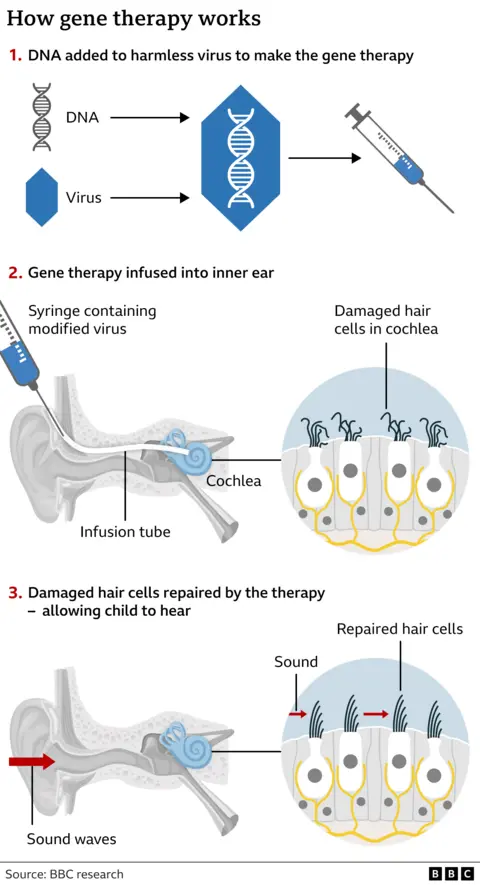
CHORD试验项目采用的基因疗法图示,来源:BBC Research[1]
由于OTOF基因突变导致的听力损失通常到儿童两三岁时才会被发现,因此CHORD试验团队希望能够在更年幼的失聪儿童身上使用基因疗法。班斯表示:“我们越早恢复听力,对失聪儿童越好,因为大脑在大概三岁之后就开始关闭语言相关的可塑性和适应能力了。”[1]一旦错过最佳治疗时机,儿童年龄越大,即使能恢复听力,要开口说话的难度仍然很大。
完整的CHORD试验分为三个阶段,第一阶段的患者包括奥帕尔在内,只在一只耳朵内接受低剂量治疗。第二阶段则预计使用更高剂量的基因疗法,但仍仅限在一只耳朵内进行,这是为了确保起始剂量安全性。在验证了前两个阶段疗法的安全性和有效性之后,到第三阶段,研究人员会招募更多儿童,在两只耳朵中同时展开基因疗法,计划总共在全球招募18名儿童参与这一前沿试验。疗程结束后,研究人员会展开为期5年的随访,以跟踪、了解患者长期适应以及语言理解的情况。[2]
今年以来,多项研究获突破
早在2022年底,DFNB9已获得了三项单独的基因治疗临床试验批准:由Sensorion开发的OTOF-GT,由Decibel Therapeutics开发的DB-OTO和由Akouos开发的AK-OTOF。到了2023年更多的试验项目展开,包括CHORD临床试验。在每年一度的听力研究协会年会上,各国公司和学术机构的研究团队都会报告各自基因疗法试验进展。[4]
今年以来,好消息频频传出,媒体先后报道了一些基因疗法成功案例。1月,《科学》和《自然》[7, 8]都曾报道美国礼来公司及其合作伙伴Akouos公司的报告,在费城临床实验中接受基因治疗的11岁摩洛哥男孩,治疗后的1个月内可以听到一些频率的声音,就和正常人一样。但他仍然无法开口说话。
同月,复旦大学附属眼耳鼻喉科医院领衔、与哈佛医学院研究人员合作的联合团队在《柳叶刀》(The Lancet)上,也发表了全球首个遗传性耳聋基因治疗的临床试验研究成果[9]。我国每年新生约3万聋儿,其中60%与遗传因素也就是基因缺陷相关。而复旦大学团队在耳鼻喉科研究院院长、科主任李华伟教授带领下,从2022年10月正式发起临床试验招募。之后,从大龄儿童到小龄儿童,陆续纳入多例患者完成基因治疗。
团队使用的也是AVV递送载体,不过因为OTOF基因超出了单个AAV的装载容量,为了克服大基因在内耳的递送问题,科研人员创新开发出双载体递送系统,将基因一分为二,每一个载体各封装一半的基因,随后将其注射入患者耳蜗中。虽然病毒会将各自的基因插入到细胞DNA的不同位置,当每一半基因表达时,细胞机制会将其合二为一,组装出完整的蛋白质,恢复细胞向大脑传递听觉信号的能力。[10]
该临床试验共有6名OTOF突变耳聋患儿接受了基因治疗。治疗后的随访期间,患者展示出良好的安全性和耐受性,最终有5名患者的听力和言语功能得到明显恢复。目前最长的患者随访时间已达1年以上,患儿已经可以进行日常对话。[5]
希望与问题并存
近期的成功案例令人振奋,学界专家也大加赞誉,特拉维夫大学的遗传学家卡伦·阿夫拉罕(Karen Avraham)表示:“这是巨大突破。”哥伦比亚大学的耳鼻喉科医生和基因治疗学家劳伦斯·卢斯蒂格(Lawrence Lustig)的实验室最先在小鼠中测试了相同的方法,他也同意:“除了人工耳蜗,我们实际上还没有任何成功的治疗失聪的方法。”
不过,冷静的科学家们也向《科学》[7]提出了一些潜在问题。
首先,治疗效果、言语改善能持续多久?
前面提及的三个试验团队都表示,接受治疗的儿童能够在没有辅助设备的情况下听到声音,而且感知到的声音质量比人工耳蜗更自然,可进一步改善听力。但卢斯蒂格仍谨慎道:“我们也许要等到这些孩子们长大之后,才能真正理解他们的语言理解能力得到多大程度的改善。”
此外,耳朵的毛细胞不会分裂,所以它们接受的OTOF基因有效拷贝应该会持续存在,指导细胞生成otoferlin蛋白质。但科学家仍然需要更多数据来确定改善情况能够持续多久。阿夫拉罕表示,基因表达能力可能会随着时间的推移而减弱,或者耳朵可能会产生免疫反应而关闭外来基因的表达。
其次,还有哪些听力障碍可能通过基因疗法得到治疗?
先前研究已表明,有可能导致失聪的基因突变超过100个,因此存在其他潜在的基因治疗靶点。但这些治疗需要时间来开发。以GJB2基因缺陷为例,这种缺陷在某些人群中占据30%的遗传性失聪总病例。GJB2基因编码连接蛋白26,这些蛋白质会释放钾,协助耳蜗中的各细胞类型进行交流。
但是,针对GJB2基因的疗法颇具挑战,因为AAV载体尚无法将所需基因可靠地添加入靶向的细胞类型中,如果将连接蛋白26添加到不需要它的细胞中,就像给后者“打了个洞”,例如毛细胞或神经元,反而会引起问题。
最后,对于没有毛细胞可修复的聋哑儿童或成年人该怎么办?
十年前,诺华制药的团队尝试使用基因疗法来治疗由于接触噪音或毒素导致听力严重丧失的成年人,促使其毛细胞再生。具体思路是让AAV载体将基因地送到相邻的耳蜗细胞中,基因所表达的蛋白质诱导其他基因表达,将邻近细胞转变为毛细胞。然而,这种疗法没有发挥预期作用,一个可能的原因是成年人耳朵内能支持修复的细胞太少了。刺激毛细胞再生可能比想象的更复杂,要实现非常具有挑战性。
医学的进一步让科学家掌握更多的创新技术以攻克遗传性疾病,正如英国国家聋哑儿童协会的高级政策顾问马丁·麦克林(Martin McLean)所说,失聪不应成为人们幸福生活的障碍,“许多家庭乐于拥抱基因疗法,我们同时也期待了解儿童接受治疗后的长期结果。”
参考文献
[1]
[2]
[3]
[4]
[5]
[6]
[7]
[8]
[9] (23)02874-X/fulltext
[10]
出品:科普中国
0
推荐




 京公网安备 11010502034662号
京公网安备 11010502034662号 