桑蚕丝在医学领域中具有广泛的应用潜力,它的天然来源、生物相容性和良好的物理特性使其成为各种医疗和生物技术应用的理想选择之一。
撰文 | MY
“丝绸”一词的英文翻译是silk,其实这个词指的是由各种昆虫幼虫(如蚕蛾、苍蝇、蝎子、蜘蛛和螨虫等)产生的蛋白质聚合物,也就是形成茧的物质。在日常生活中,光滑美丽的丝绸通常是指由家蚕(Bombyx mori,家蚕属)产生的桑蚕丝所制成的纺织品[1]。家蚕已经被人类驯化,有着数千年培育的历史。桑蚕丝在蚕桑产业中占据主导地位,市场上常见的天然丝绸大部分属于这种类型。此外,未经驯化的蚕蛾也为我们提供了丝绸的原料,常见的野生品种包括埃利丝(Philosamia ricini/Samia ricini)、穆加丝(Anthrraea asana/assamensis)和杜萨尔丝(Antheraea mylitta)等,它们并非以桑树为食[2]。
美丽的丝绸一直被认为是华丽的面料,但桑蚕丝的用途远不止如此。近年来,科学家发现了许多桑蚕丝的医学用途,其出色的物理和生物特性,正在改变生物工程学。
桑蚕丝的结构和性质
桑蚕丝主要由丝素蛋白(Fibroin)和丝胶蛋白(Sericin)组成。丝素蛋白存在于蚕丝的内部,约占蚕丝重量的70%,直径约为10–25μm。丝素蛋白由氨基酸轻链(约26 kDa ,Da为分子量单位)和重链(约390 kDa)按1:1的比例组成,两者通过二硫键相连。包裹在丝素蛋白外部的是丝胶蛋白,占总重量的30%(20–310 kDa)[3]。此外,桑蚕丝还含有约0.8-1%的脂肪/腊和1-1.4%的色素/灰分。通过将蚕茧在碱性溶液中煮沸,可以从丝胶蛋白中提取和纯化丝素蛋白[4]。
当我们谈论桑蚕丝出色的生物性能和机械性能时,实际上是在讨论丝素蛋白的特性。丝素蛋白具有独特的β-折叠结构,这些结构允许蛋白质的氢键在反平行链之间形成紧密的堆积;较大的疏水区与较小的亲水区相互交错排列,促进了丝的组装以及丝纤维的强度和弹性。正是这种独特的β-折叠结构使得家蚕丝被认为是最坚固的生物材料之一(压强大于1 GPa)[5]。
在体外培养构建人体器官组织的组织工程中,所使用的材料必须与目标组织的硬度相匹配。通常,提高生物聚合物机械强度的常见方法是“交联”,即将不同的大分子之间,或者引入大分子材料与组织进行交叉连接。然而,这其中存在的大分子化合物可能会引发细胞毒性和免疫反应等不良后果。而丝素蛋白的β-折叠结构使其无需进行任何交联步骤即可获得良好的机械强度[6]。在实际生产过程中,通过调整β-折叠结构的含量,可以获得不同形态和机械强度的丝素蛋白材料,从而为细胞附着、扩展和生长提供稳定和支持的环境[3]。因此,桑蚕丝具有很大的医学应用潜力。
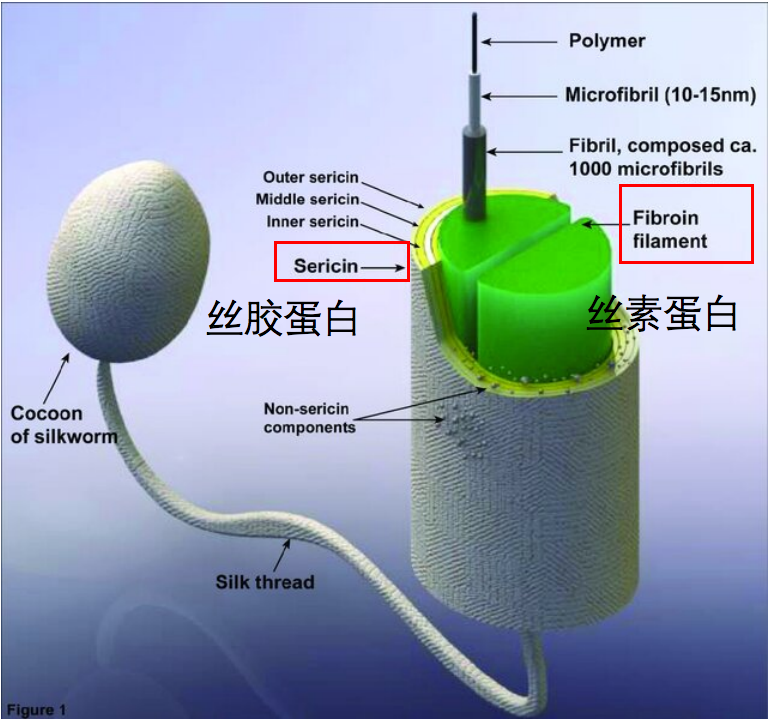
图1.蚕茧结构示意图丨图源:DOI 10.31031/RDMS.2019.10.000740
蚕丝的生物医学应用
1. 手术缝合线
医学上桑蚕丝最为广泛、也最古老的应用便是手术缝合线。常见的有吸收性和非吸收性两种形式。
公元前200年前后,希波克拉底和他的弟子们在复兴了医学思想和教学后,逐渐将外科医学传播开来。受其影响,罗马医学记者兼教师奥勒留·科尼利厄斯·塞尔苏斯(De Re Medicina)于公元 50 年左右撰写了《医学论》(De Re Medicina ),其中便描述了如何使用编织缝合线。同时期的盖伦首次描述了使用肠线作为缝合材料缝合角斗士身上切断的肌腱,并提出,如果可能的话,在用大量稀释的酒冲洗伤口后,可以尝试用丝线缝合伤口。虽然他没有将这理论付诸实践,但是他提出的将桑蚕丝作为缝合材料的理论影响了后来的人们对缝合线的探索。16 到18 世纪的时候,便已经有外科医生使用蚕丝缝合血管的记录。1986年用石炭酸浸泡的不可吸收的无菌丝线得到推广使用[7]。
随着现代科学家对蚕丝结构的探索,以丝素蛋白为主的可吸收的缝合线被创造并推广开来。吸收性缝合线不会引发人体的免疫排斥反应,并且会逐渐在体内降解吸收,不需要手术后再次取出。它们通常用于内部缝合,如组织修复或内脏手术。
2. 伤口敷料
丝素蛋白的另一大用途是伤口敷料,其不同形态的合成敷料有助于促进皮肤的再生与愈合。伤口愈合是一个复杂的过程,涉及到许多细胞与细胞基质之间的相互作用。伤口愈合的初始阶段是炎症反应的产生,该过程可持续两天。在这个阶段,凝血级联、炎症途径和免疫系统被激活,以防止血液和液体的进一步流失。第二阶段是新组织的形成,涉及到胶原/基质的沉积、上皮再生、血管生成和伤口收缩等过程[8]。
理想的伤口敷料应具备以下特征:1)保持伤口区域湿润的同时,避免过度干燥,并能吸收伤口渗出液;2)具有良好的透气性;3)能够预防细菌感染;4)具备良好的防水性[9]。为满足以上特性,丝素蛋白常被加工为薄膜、水凝胶等不同的形态的伤口敷料。常见的水凝胶敷料通常是由天然存在的壳聚糖、海藻酸盐、胶原蛋白和透明质酸等大分子聚合物制成[10]。研究人员发现丝素蛋白制作的水凝胶敷料在满足上述条件的同时,还可以诱导细胞的生长发育、迁移、增殖和细胞外基质的产生[11]。
除此之外,将丝素蛋白与其他天然水凝胶敷料混合,还可以提高它们的机械强度[12]。薄膜和多孔海绵是另外两种常见的敷料形态,它们具有较大表面积和相互连接的空隙网络,有利于组织细胞向内生长并相互粘附[3]。实验人员发现,使用丝素蛋白海绵混合胶原蛋白可以作为真皮替代品[13]。
丝素蛋白之所以能够加速伤口的愈合,是因为在与伤口接触的过程中,它会激活不同的伤口愈合细胞信号通路。首先,丝素蛋白通过NF-κB信号通路促进细胞增殖阶段常见蛋白的表达,例如表皮生长因子(EGF)、纤连蛋白、血管内皮生长因子(VEGF)、IL-10(白细胞介素10)、IL-1β、转化生长因子(TGF)和细胞周期蛋白,从而促进细胞的生长增殖和炎症的消退。其次,丝素蛋白会激活在伤口愈合中起关键作用的丝裂原激活蛋白激酶(MAPK)信号传导通路。丝素蛋白还能够影响细胞抗凋亡的一系列信号通路,促进细胞的存活,从而促进伤口的愈合[11, 14]。

图2. 丝素蛋白常见结构:A)蚕茧B)海绵结构 C)垫状宏观结构D)3D 打印多孔结构E垫状微观结构F)薄膜状 G)水凝胶。丨图片来源:参考文献[15]
3. 药物递送载体
药物递送载体是近年来热门的研究领域,这其中也有丝素蛋白的一席之地。与现在市面上常见的纳米颗粒递送系统相比,除了前文所提到的良好的生物降解性之外,丝素蛋白最大的优势是其低免疫原性,不会在体内引发免疫排斥反应。丝素蛋白的温和加工条件使其更加适合封装对加工条件敏感易失效的药物。
丝素蛋白药物载体可以被加工为水凝胶、薄膜、微米和纳米颗粒、纳米纤维和多孔海绵等结构,适用于不同的药物递送途径和治疗需求,具有更广泛的应用潜力[16]。通过对素丝蛋白结构的设计优化,可以延缓药物释放速率和增强载体稳定性,延长其在血液中的循环时间和作用效果,实现持续递送药物的目的[17]。
目前,微米颗粒和纳米颗粒已被用于将不同类型的药物(如姜黄素、阿霉素和布洛芬)以特定时间或特定位点的方式递送至各种类型的细胞。丝素蛋白薄膜已被用于控释药物(如右旋糖酐、表柔比星)和生物制剂(如IgG和HIV抑制剂)。此外,它们还被用于稳定辣根过氧化物酶(HRP)、葡萄糖氧化酶、疫苗和单克隆抗体等生物制剂,以延长其保质期[16]。
研究人员也尝试将蚕丝用于疫苗载体。位于波士顿的Vaxess公司研发的流感疫苗丝素蛋白微针贴片已经完成了一期临床实验,与此同时,针对新冠的丝素蛋白疫苗载体也在研发探索中。尽管在丝素蛋白作为疫苗递送载体的研究取得了极大进展,但这一过程仍处于探索和研发阶段,对其靶向性和特异性仍然缺乏足够的研究,距离真正产品的问世还有很长的路要走。
4. 修复组织支架
现代组织工程的目标是再生和替换受损的组织和器官。理想的材料不仅要成功替换组织或器官,还需要具有支撑作用。这意味着它应该完全融入周围组织,并且不会引发免疫反应或产生不良影响。丝素蛋白制作的支架便极好地满足了上述两点要求,在不引发免疫反应的同时,提供对细胞组织的支持和保护作用,促进相关细胞在支架上的沉积和生长,进而使受损的组织得到恢复[18]。
丝素蛋白支架被广泛探索用于韧带、肌腱和骨骼组织。骨骼是一种特殊的结缔组织,胶原蛋白和透明质酸是骨组织的主要成分。理想的骨组织支架应该在保证骨组织的韧性的同时,允许无机成分在支架上沉积来增强骨硬度和强度。就像我们在编织布料时使用丝绸线来增强织物的强度和耐久性一样,丝素蛋白支架可以为骨细胞提供一个稳定坚固且适宜的生长环境,促进骨组织的再生和修复。实验表明,丝素蛋白支架可以促进人间充质干细胞的成骨分化。此外,研究人员还发现丝素蛋白支架与其他生物材料(如胶原蛋白或磷酸钙无机成分)的结合使用,可以增强骨形态发生蛋白的表达,从而增强成骨特性[19]。
韧带和肌腱组织由胶原蛋白和纤维细胞组成,是致密的纤维结缔组织,严重缺乏自然再生能力。韧带和肌腱的高韧性和高弹性的特点使得丝素蛋白支架成为韧带和肌腱组织工程方面的首选生物聚合物[20]。实验人员通过将丝素蛋白与天然生物材料(例如I型胶原蛋白、透明质酸和明胶)以及合成材料(例如聚电解质和PLGA)混合来获得这些支架。2002年,第一个丝素蛋白矩阵成功应用于前交叉韧带 (ACL) 的设计中[21]。
除此之外,丝素蛋白还可作为修复鼓膜穿孔的理想材料。鼓膜是位于外耳和中耳之间的透明结构,接受声音的同时保护中耳[22]。如果鼓膜在3个月内没有自行修复,就会形成慢性穿孔,导致听力丧失和反复感染。鼓膜主要由角质形成细胞、成纤维细胞和胶原蛋白(II型和III型)组成。由丝素蛋白制作的支架允许人的鼓膜角质形成细胞生长增殖,同时加速鼓膜的再生,从而显著加快听力恢复速度。实验表明,将丝素蛋白制成的薄膜移植在大鼠和豚鼠耳中,与对照组相比,大鼠和豚鼠耳中的穿孔在7天后已闭合。研究人员还发现丝素蛋白薄膜具有良好的声传递能力和优异的软骨拉伸强度,表明这些膜在体内再生慢性鼓膜穿孔具有巨大潜力[21]。
小结
除了上述重要的医学工程应用,丝素蛋白还可用于制作各种类型的传感器。例如,通过对丝素蛋白进行特定的光学修饰,可以检测光吸收、荧光或折射率的变化,应用于生物传感、环境监测和医学诊断等领域。将丝素蛋白与特异性生物识别分子,如抗体、寡核苷酸或酶,链接起来,可以实现对生物分子或病原体的特异性检测,在疾病诊断、食品安全监测和生物防御等方面起到重要作用[23]。
未来,随着对丝素蛋白结构与性质的深入研究,人们将进一步探索其与生物体的兼容性,以及在组织工程和再生医学中的潜在应用。丝素蛋白支架可能会被设计用于更复杂的组织修复,如心脏、肝脏和肺部等器官的再生;研究人员将会设计出具有靶向性和可控释放功能的丝素蛋白药物载体,用于治疗癌症、炎症和感染性疾病,等等。
相信未来将出现更多种类、更多形态的丝素蛋白制品,为人类生活带来更多的便利。桑蚕丝,将成为推动人类健康和生活质量的重要力量。
参考文献
[1] Nguyen, T.P., et al., Silk Fibroin-Based Biomaterials for Biomedical Applications: A Review. Polymers (Basel), 2019. 11(12).
[2] Holland, C., et al., The Biomedical Use of Silk: Past, Present, Future. Advanced Healthcare Materials, 2019. 8(1): p. 1800465.
[3] Qi, Y., et al., A Review of Structure Construction of Silk Fibroin Biomaterials from Single Structures to Multi-Level Structures. Int J Mol Sci, 2017. 18(3).
[4] Rockwood, D.N., et al., Materials fabrication from Bombyx mori silk fibroin. Nat Protoc, 2011. 6(10): p. 1612-31.
[5] Cheng, Y., et al., On the strength of β-sheet crystallites of <i>Bombyx mori</i> silk fibroin. Journal of The Royal Society Interface, 2014. 11(96): p. 20140305.
[6] Lee, J., et al., Development of Silk Fibroin-Based Non-Crosslinking Thermosensitive Bioinks for 3D Bioprinting. Polymers, 2023. 15(17): p. 3567.
[7] Muffly, T.M., A.P. Tizzano, and M.D. Walters, The history and evolution of sutures in pelvic surgery. J R Soc Med, 2011. 104(3): p. 107-12.
[8] Almadani, Y.H., et al., Wound Healing: A Comprehensive Review. Semin Plast Surg, 2021. 35(3): p. 141-144.
[9] Dhivya, S., V.V. Padma, and E. Santhini, Wound dressings - a review. Biomedicine (Taipei), 2015. 5(4): p. 22.
[10] Nguyen, H.M., et al., Biomedical materials for wound dressing: recent advances and applications. RSC Adv, 2023. 13(8): p. 5509-5528.
[11] Mazurek, Ł., et al., Silk Fibroin Biomaterials and Their Beneficial Role in Skin Wound Healing. Biomolecules, 2022. 12(12).
[12] Zhang, H., et al., Silk fibroin hydrogels for biomedical applications. Smart Medicine, 2022. 1(1): p. e20220011.
[13] Naomi, R., J. Ratanavaraporn, and M.B. Fauzi, Comprehensive Review of Hybrid Collagen and Silk Fibroin for Cutaneous Wound Healing. Materials (Basel), 2020. 13(14).
[14] Park, Y.R., et al., NF-κB signaling is key in the wound healing processes of silk fibroin. Acta Biomaterialia, 2018. 67: p. 183-195.
[15] Belda Marín, C., et al., Silk Polymers and Nanoparticles: A Powerful Combination for the Design of Versatile Biomaterials. Frontiers in Chemistry, 2020. 8.
[16] Wani, S.U.D., et al., Silk Fibroin as an Efficient Biomaterial for Drug Delivery, Gene Therapy, and Wound Healing. Int J Mol Sci, 2022. 23(22).
[17] Tiwari, G., et al., Drug delivery systems: An updated review. Int J Pharm Investig, 2012. 2(1): p. 2-11.
[18] Lee, E.J., F.K. Kasper, and A.G. Mikos, Biomaterials for tissue engineering. Ann Biomed Eng, 2014. 42(2): p. 323-37.
[19] Li, M., et al., A Comprehensive Review on Silk Fibroin as a Persuasive Biomaterial for Bone Tissue Engineering. International Journal of Molecular Sciences, 2023. 24(3): p. 2660.
[20] Tang, Y., et al., Functional biomaterials for tendon/ligament repair and regeneration. Regen Biomater, 2022. 9: p. rbac062.
[21] Sun, W., et al., Silk Fibroin as a Functional Biomaterial for Tissue Engineering. International Journal of Molecular Sciences, 2021. 22(3): p. 1499.
[22] Sainsbury, E., et al., Tissue engineering and regenerative medicine strategies for the repair of tympanic membrane perforations. Biomater Biosyst, 2022. 6: p. 100046.
[23] Ru, M., et al., Recent progress in silk-based biosensors. International Journal of Biological Macromolecules, 2023. 224: p. 422-436.
出品:科普中国
0
推荐




 京公网安备 11010502034662号
京公网安备 11010502034662号 