她背着一枚可能在人生任何阶段“引爆”的“定时炸弹”,没有人可以预测疾病发作的时间,但症状一旦出现,病情进展将极为迅速,那时等待她的只能是死亡的结局。
尽管她和丈夫都毫无生物医学背景,但为了与时间赛跑,他们共同选择了一条试图逆天改命的道路——自己研究朊病毒病,寻找照亮自己,同时拯救更多患者的道路。
编辑 | 药明康德内容团队
2009年,正在哈佛法学院攻读法律职业文凭的Sonia Vallabh迎来了人生的幸福时刻,她与正在麻省理工学院攻读城市规划与交通硕士的Eric Minikel走入了婚姻殿堂。但仅仅一年之后,一场重大变故彻底改变了这对新人的人生。

Eric Minikel(左)与Sonia Vallabh(右)丨图片来源:博德研究所致命的错误折叠
Vallabh的母亲生病了。起初还只是视力模糊,但很快各种症状都缠上身,Vallabh母亲的身体状况急转直下,她失去了行走能力,无法与人交流,无法进食……在出现症状的仅仅10个月后,Vallabh的母亲在恐惧中去世。但在这段时间内,始终没有人知道真正的病因是什么,直到尸检报告告诉了Vallabh一个无比残酷的结果。
她的母亲死于致死性家族性失眠症(fatal familial insomnia)——一种遗传性朊病毒病。
在我们的大脑中,有一类被称为朊病毒蛋白(prion protein, PrP)的细胞表面蛋白。正常情况下,PrP并不是什么坏角色,也不会造成健康后果。然而,一旦PrP改变构象,“多米诺骨牌”开始倒下了。错误折叠的PrP会形成有毒的聚集体,然后在大脑内扩散传播,导致神经元死亡,这类致命且无法治愈的疾病就是朊病毒病。
我们最熟悉的朊病毒病是具有传染性的疯牛病;除此之外,另一些朊病毒病也可以由基因突变引起,Vallabh母亲患上的致死性家族性失眠症就是PRNP D178N基因突变的结果。PRNP D178N突变属于常染色体显性遗传,这意味着Vallabh有50%的概率继承这个致命基因。
是将这样的担忧藏在心里,还是主动去了解自己的命运?一年之后,Vallabh选择抛出这枚决定命运的硬币。基因检测的结果是,Vallabh也携带了PRNP D178N突变。也就是说,Vallabh背上了一枚可能在人生任何阶段“引爆”的“定时炸弹”,没有人可以预测疾病发作的时间,但症状一旦出现,病情进展将极为迅速,那时等待Vallabh的只能是死亡的结局。
从零开始,逆天改命
面对这样被“将死”的局面,对于毫无生物医学背景的Vallabh来说,最合乎常理的做法自然是继续自己的工作与生活,同时期待朊病毒领域的疗法突破——毕竟,虽然算不上热门领域,但全球范围内还是有一些科学家在研究朊病毒病。如果运气好,Vallabh还有几十年的时间来等待。
但为了与时间赛跑,Vallabh和丈夫Minikel共同选择了一条试图逆天改命的道路——自己研究朊病毒病,寻找照亮自己,同时拯救更多患者的道路。
2012年,Vallabh和Minikel辞去了工作,从零开始学习生物学,并在马萨诸塞州总医院找到了第一份基础的研究工作。很快他们意识到,还需要更多科学知识才能有机会成功。2014年,两人同时申请到著名的博德研究所读博,他们在5年后毕业,并在博德研究所组建了自己的实验室,开始对罕见的朊病毒病的研究。
与一些科学家将基金周期作为研究时间期限不同,他们的期限是Vallabh体内随时启动的“炸弹”倒计时。令人惊叹的是,这对半路出家的科学家在研究上很快就取得了进展。
2019年,这对夫妻与合作者在PNAS杂志上提出了利用现有工具监测脑脊液中PrP水平的新策略;一年后,他们更是在Nucleic Acids Research杂志上提出,通过反义寡核苷酸(ASO)介导,即使是不足25%的PrP抑制,也可以延长感染朊病毒小鼠的生存期并延迟疾病发作。值得一提的是,目前这款基于ASO的候选药物ION717正处于临床试验阶段。
与此同时,Vallabh和Minikel也没有停下探索的脚步。与Whitehead生物医学研究所的Jonathan Weissman教授合作,这对夫妻的又一项研究突破登上了6月28日的《科学》杂志!这支研究团队合作开发了一款名为CHARM的表观遗传编辑工具,其可以沉默整个大脑中编码PrP的基因,为致命朊病毒病以及其他由有害蛋白聚集引起的神经退行性疾病患者提供了潜在的治疗策略。

全新表观遗传编辑器
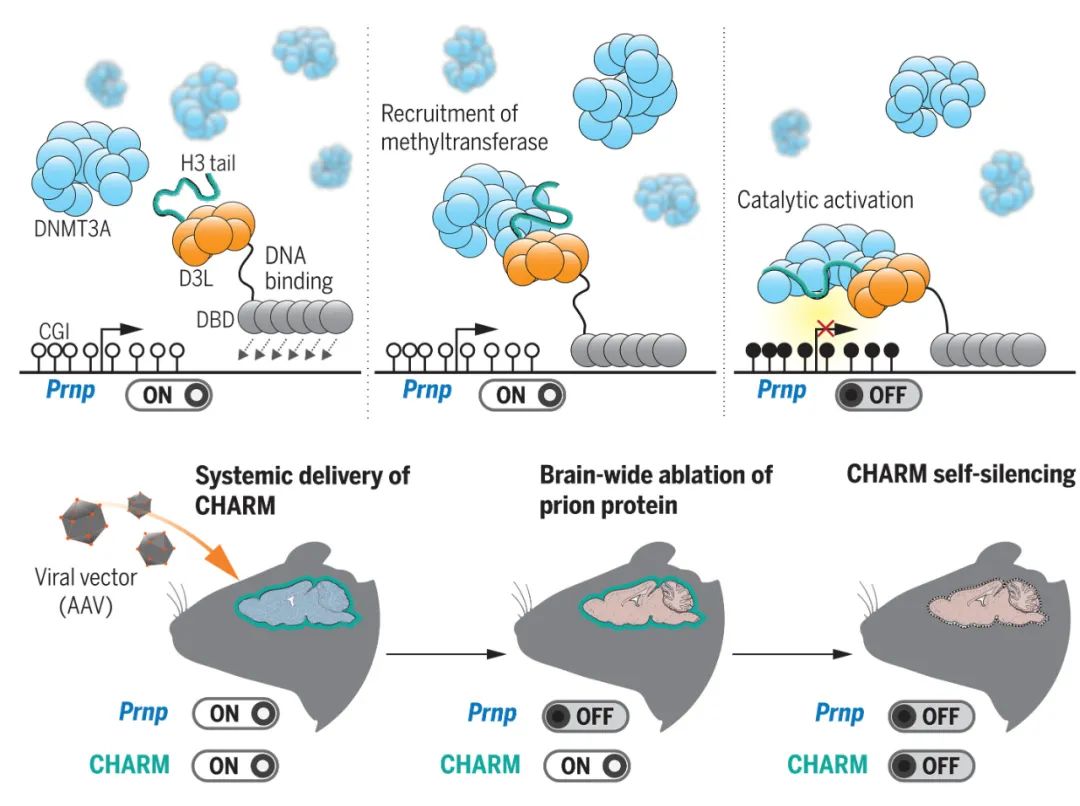
最新研究的CHARM表观遗传编辑器示意图丨图片来源:参考资料[1]
这项研究的起点,要追溯到2021年时,Weissman在《细胞》杂志发表的一款基因沉默工具——CRISPRoff。要抑制PrP的生成,一个思路就是沉默目标基因。而CRISPRoff使用CRISPR基因编辑技术的构建模块,并利用Cas9核酸酶实现目标DNA的切割,将编辑器引导至目标基因。CRISPRoff包含一个 DNA甲基转移酶结构域(DNMT3A),可以通过定点甲基化的表观遗传修饰对目标基因实现长期的沉默。
此前的研究证实了CRISPRoff可以稳定、有效地沉默编码PrP的基因。不过,CRISPRoff的几个缺陷还是限制了它的应用。
首先是尺寸问题。我们知道腺相关病毒 (AAV) 是向大脑递送药物的常用载体,和任何“货轮”一样,它们能装载的“货物”大小是有限的。不幸的是,Cas9蛋白就属于大型货物,无法用单个AAV载体进行递送。因此,妥协方案只能是加大剂量、用多个AAV载体进行装载,但这又会导致细胞毒性增加。另一个问题是,CRISPRoff编辑器的长期表达会带来有害免疫反应以及脱靶效应的风险。
因此,Weissman与Vallabh、Minikel合作的目标,就是打造出不仅同样有效,并且体积足够小、足够安全,能最大限度避免基因沉默时出错的新型编辑工具。
首先要解决的就是尺寸问题。CRISPRoff使用的Cas9太大了,研究团队的解题方案是放弃CRISPR,转而创建了一种基于锌指蛋白(ZFP)的表观基因组编辑器“ZFPoff”。其中,锌指蛋白扮演了Cas9的角色,引导编辑工具抵达目标基因。由于体积小得多,单个AAV就能实现对新型编辑器的递送。同时,由于锌指蛋白常见于人类细胞,因此也无需担心自身免疫反应的风险。
解决了递送问题后,下一个挑战是如何进行基因沉默。由于CRISPRoff添加的DNA甲基转移酶结构域DNMT3A会产生细胞毒性,在这里研究人员想到了另一种策略——不再是从外部运送DNMT3A,而是直接招募细胞自身的内源性DNMT3A,从而在避免细胞毒性的同时还进一步减少了载荷。
DNMT3A本身是无活性的,接下来研究团队还提出了在目标位点激活DNMT3A的巧妙策略。他们将DNMT3A的伴侣分子组合后连接到锌指蛋白上,而锌指蛋白会抵达目标PrP基因,因此内源性的DNMT3A就会在遇到目标基因时被激活,起到沉默基因的作用。
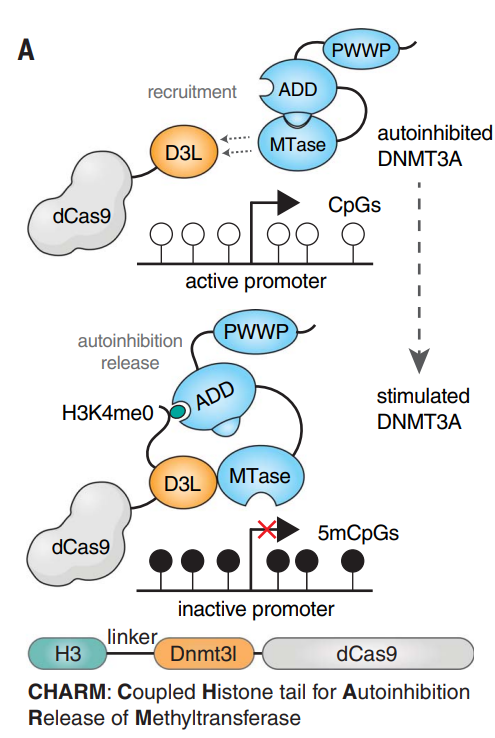
CHARM招募内源性DNMT3A,并且实现了对DNMT3A的激活丨图片来源:参考资料[1]
最后,这项研究还解决了此前CRISPRoff存在的脱靶问题。在他们的设计中,其中一个编辑器靶向AAV载体中的启动子,因此新型编辑器在完成基因沉默的任务后,可以自行关闭所有编辑器的表达、实现自我沉默,从而避免了编辑工具长期表达可能导致的不利影响。
长期抑制致命蛋白
以上,就是Vallabh等人交上的一份名为CHARM(全称为Coupled Histone tail for Autoinhibition Release of Methyltransferase)的漂亮答卷。在小鼠实验中,CHARM可以敲低全脑中80%以上的PrP表达,远超改善症状所需的PrP抑制幅度。要知道,在Vallabh等人之前的研究中,不足25%的PrP抑制已经能够起效。此外,CHARM编辑器在沉默目标基因后实现了自我沉默,并且没有导致细胞毒性以及其他不利影响。
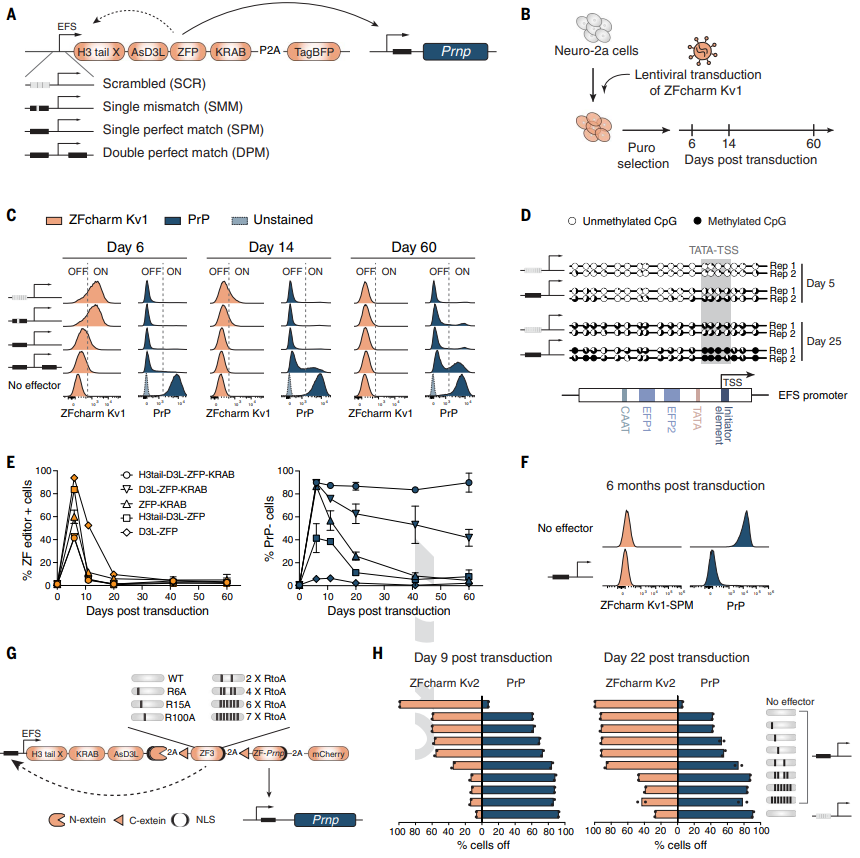
CHARM的短暂表达实现了对PrP的长期抑制丨图片来源:参考资料[1]
对于这项可能带来革命影响的工具,同期的观点文章评论道:CHARM的开发引入了一种有效且安全的编辑技术,其可通过AAV递送至大脑等难以靶向的器官,从而实现基因沉默。尽管通过甲基化实现基因沉默的持久性仍有待确认、基因沉默可能仅对部分疾病有用,但CHARM等表观遗传编辑器最终可能对人类健康产生类似于碱基编辑、先导编辑等工具的巨大影响。
研究团队指出,目前他们正在对CHARM进行调整,并且实现了工具的模块化,进一步提升其有效性、安全性以及进行大规模生产的能力。
从实验室的基础研究到最终疗法,总是伴随着漫长而曲折的道路。对于Vallabh来说,这支“悬顶之剑”还没有被取下,这场与时间赛跑,拯救自己以及更多患者的比赛也没有理由止步。正如Vallabh此前在博德研究所网站上写的那样:我们将继续前进,不断更新对“前进”的理解。
参考资料
[1] Edwin N. Neumann et al., Brain-wide silencing of prion protein by AAV-mediated delivery of an engineered compact epigenetic editor. Science (2024). DOI: 10.1126/science.ado7082
[2] A CHARMed collaboration created a potent therapy candidate for fatal prion diseases. Retrieved June 28, 2024 from
[3] Vallabh, S. M. et al. Prion protein quantification in human cerebrospinal fluid as a tool for prion disease drug development. PNAS 201901947 (2019)
[4] Minikel, E. V. et al. Prion protein lowering is a disease-modifying therapy across prion disease stages, strains and endpoints. Nucleic Acids Res. (2020)
[5] James K. Nuñez et al., Genome-wide programmable transcriptional memory by CRISPR-based epigenome editing. Cell (2021). DOI: 10.1016/j.cell.2021.03.025
本文经授权转载自微信公众号“学术经纬”。
0
推荐




 京公网安备 11010502034662号
京公网安备 11010502034662号 