新一轮研究正在揭示癌症与神经元之间的关系,并寻找办法阻止其交互。
撰文 | McKenzie Prillaman
翻译 | 施普林格·自然上海办公室
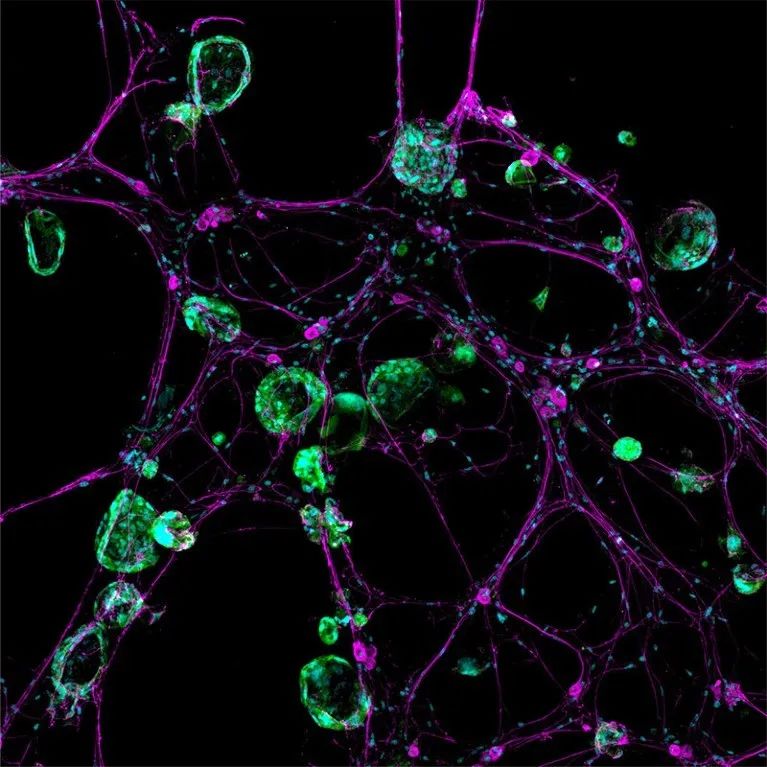
三维模型系统展示了神经细胞(品红)与癌细胞(绿色)之间的相互作用。来源:Jennifer Su, Peter Wang, Nicole Lester, William L. Hwang/麻省理工学院科赫研究所和麻省总医院
青绿色的闪电在电脑屏幕上乱闪,这一幕让癌症神经科学家Humsa Venkatesh目瞪口呆。那是2017年底,她正在观察胶质瘤(一种人类脑肿瘤)细胞中的电活动风暴。
Venkatesh本以为癌变脑细胞之间会像健康脑细胞之间一样,有一些背景音对话,但实际上细胞之间的对话连续且迅速。“我看到这些肿瘤细胞正被点亮”,她当时是斯坦福大学医学院的一名博士后研究员,“它们明显处于电活跃状态。”
她立即开始思考其中的含义。科学家们从未想过癌细胞(即使是大脑中的癌细胞)在一定程度上也能相互交流。也许肿瘤不断进行的电通讯有助于它的生存,甚至生长。Venkatesh说:“我们研究的是癌症,而不是神经元,也不是任何其他细胞类型。”看到细胞如此活跃“确实令人震惊”。Venkatesh现在就职于哈佛医学院。
Venkatesh的研究成果是于2019年发表在《自然》上的论文[1]的一部分,同时发表的另一篇文章[2]也得出了同样的结论:神经胶质瘤具有电活性。肿瘤甚至可以将自己连接到神经回路中,直接接受来自神经元的刺激,这有助于肿瘤的生长。
这些发现在新兴的癌症神经科学领域举足轻重,研究人员正在解析癌症(甚至是脑外癌症)为自身利益与神经系统合作的多种方式。与肿瘤利用血管为自身提供营养和生长一样,癌症从发病到扩散也依赖于神经系统。
肿瘤学与神经科学之间的相互作用刚刚开始在肿瘤环境中这个曾经被忽视的部分中显现出来。科学家们开始了解哪些神经元和信号与此有关,但这些新发现的与免疫系统相互作用使情况变得更加复杂。随着研究人员对癌症与神经系统之间关系的深入研究,针对这种联系的疗法也在不断涌现。其中一些疗法利用现有药物改善癌症患者的治疗效果。
澳大利亚莫纳什大学的癌症生物学家Erica Sloan说:“我们的目标是帮助病人。从知识角度了解生物学层面上发生了什么确实让人满足。但关键目标是,我们如何将其应用到实践中?”
侵犯与驯服
近200年前,科学家首次发现癌细胞与神经元之间的联系。19世纪中叶,法国解剖学家和病理学家Jean Cruveilhier描述了一例乳腺癌侵犯负责面部运动和感觉的颅神经的病例。
这是关于神经周围侵袭的首次报道,在这种侵袭中,癌细胞穿梭于神经内部和周围,然后扩散。这种现象是侵袭性肿瘤的标志,预示着不良的预后。
长期以来,科学家和医疗专业人士认为,神经被动地充当了运送癌症及其相关疼痛的高速公路。斯坦福大学医学院的神经肿瘤学家Michelle Monje说,许多人认为神经系统是“受害者——被癌症破坏或损害的结构”。她也是Venkatesh的导师。
但在20世纪90年代末,泌尿科病理学家Gustavo Ayala(现就职于休斯顿得克萨斯大学健康科学中心)开始对这种相互作用进行更深入的研究。他把小鼠的神经放在布满人类前列腺癌细胞的培养皿中。在24小时内,神经开始长出名为神经突的小分支,并伸向患病细胞。一旦接触到癌细胞,癌细胞就会沿着神经移动,直到到达神经元细胞体[3]。
神经并不只是旁观者:它们会主动寻求与癌症联系。Ayala说:“我觉得真的是这样,决定在职业生涯中追寻它。”他很快就成了有名的“那个搞神经的家伙”。他说:“他们不是在取笑我,但他们不怎么赞同我在这个领域里的兴趣。”
2008年,Ayala报告了另一个奇怪的现象。与健康前列腺标本相比,从前列腺癌手术后的患者那里获取的肿瘤标本中含有更多的神经纤维(称为轴突)[4]。
不过也不是所有人都觉得这个结果奇怪。一些科学家开始将肿瘤视为器官本身,因为肿瘤包含多种细胞类型、支架结构、血管和其他元素,这些元素使肿瘤有别于癌细胞团块。
但是,“我们的研究还缺少一个部分,就是神经。”法国国家健康与医学研究所的癌症生物学家Claire Magnon说。
这一预感促成了Magnon团队2013年发表的一篇突破性论文。她和同事记录了小鼠前列腺肿瘤内部和周围神经纤维的生长情况[5]。此外,切断与神经系统的连接可使疾病停止。几年后,大量研究表明,同样的情况也发生在其他部位的癌症中,包括胃癌、胰腺癌和皮肤癌。一些被隔开的神经会带来与癌症相关的疼痛,研究人员已经知道,阻断胰腺癌患者的这些神经通路可以缓解疼痛。
“就像群星汇聚到了正确的位置。”匹兹堡大学的神经科学家Brian Davis说。这些汇聚在一起的结果表明,“肿瘤微环境中的这一过去基本被忽视的组成部分,其实发挥着某种作用”。
击中神经
这些浸润癌症的神经从何而来,依旧令研究人员感到困惑。随后几年的研究表明,肿瘤中的细胞可以变成神经元,或者至少获得类神经元特征。2019年,Magnon和她的同事们报告了另一个起源[6]。她们观察到在小鼠中,神经祖细胞通过血液到达前列腺肿瘤,在那里定居并转变为神经元。不知何故,癌症影响了包含这些细胞的大脑区域——室管膜下区。人们已经知道在小鼠体内这些细胞有助于治愈某些脑部疾病,如中风。一些证据表明,在成年人类中,同一区域也会产生神经元,但这一观点还存在争议。
第二年,另一个研究小组发现,癌症可以迫使神经元改变其身份。在对小鼠口腔癌的研究中,研究人员发现,一组向大脑传递感觉的神经(称为感觉神经元)获得了口腔中罕见的另一种神经元(交感神经元)的特征,这种神经元负责“战或逃”反应[7]。
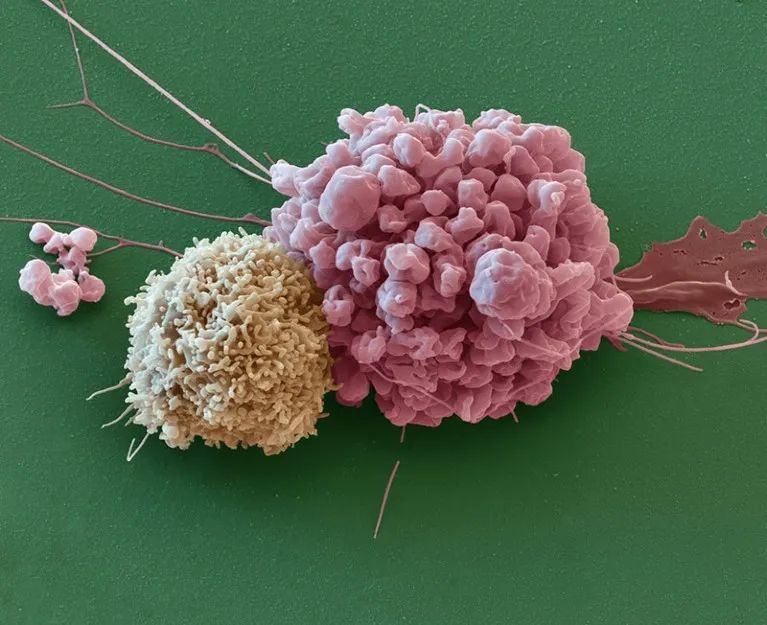
免疫细胞(左)与脑膜瘤细胞相邻。图片来源:Eye of Science/科学图片库
得克萨斯大学MD安德森癌症中心的癌症神经科学家Moran Amit说:“现在它们有了两种角色。这种转变可能有助于肿瘤生长,因为交感神经已被证明对某些癌症有益。”
但是,神经类型与其对肿瘤影响之间的关系是复杂的。例如,在胰腺中,两种对肿瘤具有相反作用的神经之间存在着拉锯关系。交感神经参与了助长癌症生长的恶性前馈循环。交感神经释放信号,指示病变细胞分泌一种叫做神经生长因子的蛋白质,从而吸引更多的神经纤维。与交感神经相对应的副交感神经负责“休息和消化”反应,它们会发出化学信息,阻止疾病的发展。
但在胃癌中,副交感神经信号的作用恰恰相反,它会促进肿瘤生长。在前列腺癌中,两种类型的神经都会帮助肿瘤生长,交感神经会在癌症发展的早期阶段提供帮助,而副交感神经则会在后期阶段促进肿瘤扩散。
哥伦比亚大学的胃肠病学家Timothy Wang说:“每种癌症与神经系统的相互作用方式都有些不同”。这意味着治疗目标必须针对癌症类型以及癌症与神经系统的联系或利用方式。
神经元可以对癌症产生直接影响,也可以通过抑制免疫系统使其无法有效对抗肿瘤而间接发挥作用。2022年的一项发现提示了这样一种机制:由感觉神经释放的一种名为降钙素基因相关肽(CGRP)的化学物质可以抑制某些免疫细胞的活动,使它们无法抵御癌症[8]。
神经元可以抑制免疫细胞的活动来保护自身,因为过多的炎症会伤害神经元。因此,匹兹堡大学的癌症神经科学家Jami Saloman说,神经不仅为癌症的扩散提供了途径和框架,而且似乎还提供了一个安全的港湾。
Davis说,肿瘤可以“把自己塞进神经里”,因为药物很难进入神经,所以肿瘤在神经里不会受到免疫系统和药物的影响。他指出:“癌细胞在等待生物制剂和化疗风暴过去时可以在那里消磨时间。然后卷土重来。”
接管中枢
一些最具侵袭性的癌症会影响大脑。Venkatesh等人发现,癌细胞甚至直接与神经元形成突触,突触信号有助于癌细胞生长。
与2019年的两篇脑肿瘤论文同时发表的一篇论文显示,大脑中的乳腺癌转移灶也能形成类似突触的连接[9]。而且此前的研究已将脑转移与认知障碍联系起来。
脑肿瘤似乎还有更多类似脑细胞的作用方式。去年11月,Monje实验室报告道,胶质瘤利用一种经典的脑信号传导方法加强了神经元输入[10]。当接触到一种有助于神经元生长的蛋白质——脑源性神经营养因子时,胶质瘤细胞的反应是产生更多可以接收神经元信号的受体。
“这与健康神经元在学习和记忆中使用的机制完全相同。”Monje说。“癌症其实并没有发明什么新东西——它只是劫持了现有过程”。
此外,就像神经元网络一样,一些胶质瘤细胞也能产生自己的有节律的电活动波[11]。海德堡德国癌症研究中心的神经肿瘤学家Frank Winkler说:“它们就像一颗颗跳动的小心脏。”他的实验室进行了这项研究。
几年前,Winkler的研究小组就开始研究这种被称为肿瘤微管的线状桥梁网络。那些辐射到整个肿瘤细胞的电活动就是通过这个结构完成的。这种活动协调了癌细胞的增殖和存活——就像起搏神经元在神经回路形成过程中协调活动一样。Winkler说:“癌症又一次劫持了神经发育的重要神经机制。”
脑癌甚至会对整个网络产生影响。去年五月的一项研究发现,胶质瘤可以重塑大脑中的整个功能回路[12]。研究人员要求肿瘤浸润语言生成区的患者说出音频描述或图片显示的物品名称。他们大脑表面的电极显示,语言任务不仅刺激了那些关键的语言区域(整个肿瘤浸润区域),包括那些通常不参与语言生成的区域,也出现了活动激增。肿瘤与大脑其他区域的功能连接越紧密,患者在任务中的表现就越差,预期寿命也越短。
这项研究的共同作者Monje说:“肿瘤重塑了功能性语言回路,滋养自己。”她还记得自己看到结果时的惊恐。“回想起第一次看到这些数据时,我浑身起鸡皮疙瘩。”
从实验室到临床
这些初步发现已经为潜在的癌症疗法指明了方向。它们还暗示了为什么现有的治疗方案常常会带来大脑耗竭的副作用。Venkatesh说,许多接受化疗的人都会出现认知能力下降或“化疗脑”,身体其他部位的神经纤维也会退化。
她补充说,尽管化疗是治疗癌症的有效方法,但如果化疗破坏了身体其他部位的神经元,“这显然对病人不利。”
其中一种策略是针对神经系统的特定部分。而现有的疗法或许能帮上忙。Amit说:“我们拥有针对几乎每个神经系统分支的药物。这些药物大多具有非常成熟的安全性。”
例如,β受体阻滞剂可以干扰交感神经发出的信号,而交感神经可以促进乳腺癌、胰腺癌、前列腺癌和其他癌症进展。自20世纪60年代以来,这类药物一直被用于治疗高血压等心脏问题,有时也用于治疗焦虑症。
过去十年来,Sloan一直想重新利用这些药物,但起初她遇到了阻力。她回忆起人们经常说,“β受体阻滞剂对癌症要是能有什么作用,我们早就会知道了。”
为了探索其中的联系,她领导了一项二期临床试验,在乳腺癌患者中测试β受体阻滞剂普萘洛尔。该研究于2020年发表。服用这种药物仅一周,就减少了癌症潜在转移的迹象[13]。另一项二期试验的灵感来自于观察性研究,这些研究将使用β受体阻滞剂与更佳健康结局关联,试验结果表明,在乳腺癌患者中联合使用化疗和普萘洛尔是安全的[14]。去年,Sloan发现该药能增强一种常见的化疗的效果[15]。
其他研究人员正在重新利用中断神经元通信的药物,包括针对癫痫发作和偏头痛开发的药物。至少有一项临床试验的目的是利用一种抗癫痫药物来阻断神经元与胶质瘤中癌细胞之间形成的突触,这种药物可以镇静过度兴奋的细胞。
另一项处于计划阶段的试验将研究接受免疫疗法治疗皮肤癌或头颈部癌症的患者是否也能从服用偏头痛药物中获益。据认为,偏头痛可能是由高水平的CGRP触发的,这种分子能削弱癌症中某些免疫细胞的活性。因此,阻断CGRP受体的药物可以抵消CGRP,让免疫细胞再次帮助对抗癌症。
Venkatesh 认为,要控制疾病,可能需要多种相互补充的药物。她说:“确实没有什么灵丹妙药。”
这一领域才刚刚开始揭开这种潜藏关系,问题层出不穷。Winkler说:“我想我需要五十辈子才能搞清一切。”
参考文献
[1] Venkatesh, H. S. et al. Nature 573, 539–545 (2019).
[2] Venkataramani, V. et al. Nature 573, 532–538 (2019).
[3] Ayala, G. E. et al. Prostate 49, 213–223 (2001).
[4] Ayala, G. E. et al. Clin. Cancer Res. 14, 7593–7603 (2008).
[5] Magnon, C. et al. Science 341, 1236361 (2013).
[6] Mauffrey, P. et al. Nature 569, 672–678 (2019).
[7] Amit, M. et al. Nature 578, 449–454 (2020).
[8] Balood, M. et al. Nature 611, 405–412 (2022).
[9] Zeng, Q. et al. Nature 573, 526–531 (2019).
[10] Taylor, K. R. et al. Nature 623, 366–374 (2023).
[11] Hausmann, D. et al. Nature 613, 179–186 (2023).
[12] Krishna, S. et al. Nature 617, 599–607 (2023).
[13] Hiller, J. G. et al. Clin. Cancer Res. 26, 1803–1811 (2020).
[14] Hopson, M. B. et al. Breast Cancer Res. Treat. 188, 427–432 (2021).
[15] Chang, A. et al. Sci. Transl. Med. 15, eadf1147 (2023).
本文经授权转载自微信公众号“自然系列”,原文以How cancer hijacks the nervous system to grow and spread标题发表在2024年1月31日《自然》的新闻特写版块上:。
0
推荐




 京公网安备 11010502034662号
京公网安备 11010502034662号 