阅读:0
听报道
疫情暴发时,增强疫情信息的透明度、可信度和及时性,加强国内和国际合作,利用各种资源来鉴别病原体,让国际社会共同参与——这是SARS给我们留下的宝贵教训。
撰文 | 李懿泽(宾夕法尼亚大学医学院)
2019年末,武汉暴发“不明原因肺炎”。2020年1月9日,以中国疾控中心徐建国院士为首的团队向公众发布消息称,在武汉的不明原因肺炎患者体内分离并检测到了一种新型冠状病毒。发稿时的最新数据显示,截至1月19日22时,武汉累计报告新型冠状病毒感染的肺炎病例198例,其中治愈25例,死亡3例。
经历过2003年非典疫情的人对冠状病毒不会陌生。那场可怕传染病的病原体正是一种冠状病毒。如今,与SARS病毒相近的新型冠状病毒在中国大陆卷土重来,我们应该怎样应对?本世纪以来,高致病性冠状病毒在人类社会已出现三次暴发(SARS、MERS以及本次不明肺炎),过往的防疫战斗能带给我们什么样的启示,我们该怎样渡过眼前的疫情?
“疾如风,徐如林,侵掠如火,不动如山。”军事家孙子这样描述一支强大的军队。
疾和病组成疾病。疾,在汉语中也有快的意思。用“疾如风”“侵掠如火”来形容一场烈性传染病的传播扩散是毫不夸张的。
人类的历史也是跟传染病做斗争的历史。天花、鼠疫、流感、艾滋病导致的死亡人口超过数亿,也因此改变了人类历史的进程。在此过程中,高致病性*冠状病毒(coronavirus)一直躲在不为人知的角落,从未在历史记录中留下大暴发的记录。在SARS病毒发现之前,人类已知的冠状病毒主要有两种:TGEV (Transmissible gastroenteritis coronavirus) 是一种感染猪的病原体, IBV (Avian infectious bronchitis virus) 是一种感染家禽的病原体。这两种病毒在畜牧兽医行业具有重要性,但并不会感染人。会感染人的冠状病毒,如Coronavirus HCoV-OC43、HCoV-229E,通常只会引起普通的感冒症状,罕有引起严重疾病的报告。因此,冠状病毒研究未能得到重视。在非典之后,另有两种低致病性冠状病毒被发现,分别是 HCoV-NL63、HCoV-HKU1。还有两种高致病性冠状病毒,它们分别是2012年发现的中东呼吸道病毒 MERS-CoV和最近武汉暴发的新型冠状病毒(WHO暂命名为2019-nCoronavirus)[1]。
*注:病毒的高、低致病性是指对人类而言。
一、不被重视的研究
虽然非典已经过去了18年,宾夕法尼亚大学的Susan Weiss教授仍然对一个电话记忆犹新。北卡罗来纳大学教堂山分校的Ralph Baric教授告诉她:“我的天!是一种冠状病毒!”
Weiss 博士和Baric博士是世界上最早研究冠状病毒的一批科学家。上世纪80年代初,他们开始研究一种鼠肝炎病毒(mouse hepatitis virus ,MHV),这种病毒能感染小鼠,根据感染方式不同,它可以导致肝炎或脑炎。MHV不能感染人,可以作为一种模式病毒用来研究冠状病毒。2002年,Baric和Weiss合作建立了世界上第一个以片段组装为基础的鼠肝炎病毒反向遗传系统,依靠这套系统,科学家可以对病毒基因组进行遗传操作,以研究病毒的致病机理[2]。
科学研究是需要经费的,即便是取得了这样的重要进展,Baric依然举步维艰,申请经费屡次被驳回——没有资助,意味着他的研究无法开展了。我们可以脑补一下经费申请的审议过程:“这种病毒重要吗”“不重要”“它能感染人吗”“不能”“那你研究它干什么”“……”回忆起这段艰难的时刻,Baric说,他欲哭无泪,坐在办公室开始思考未来的职业道路,如果必须要放弃钟爱的科研事业,他会考虑去做一个救生员或游泳教练。然而,非典的暴发改变了他的命运。当得知这场传染病的罪魁祸首是冠状病毒的时候,他给Weiss打了电话,于是就出现了本节开头的那一幕。
基础研究看似毫无用处,但是MHV的研究为后来发现和鉴定出“非典是由冠状病毒导致的”提供了非常好的科学基础。如果没有早先看似无用的MHV的研究,人类无法得知冠状病毒是什么样子的,也就无法根据电镜结果判断出非典是一种冠状病毒导致的疾病。
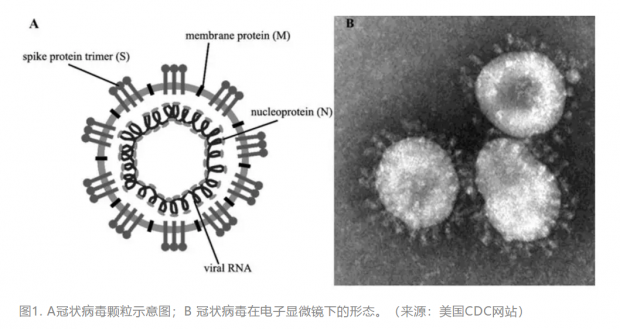
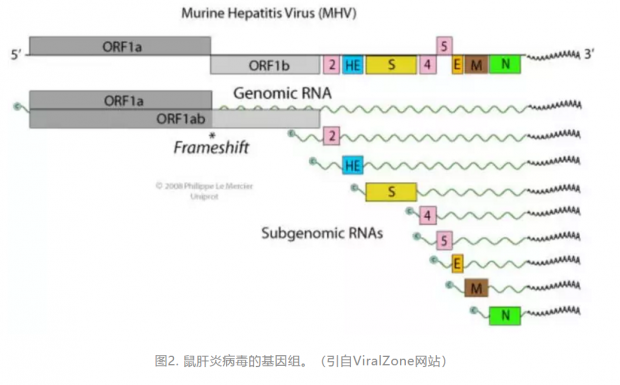
冠状病毒的名字源自于它的形态:在电子显微镜下,这种病毒颗粒看起来像一顶王冠。以形态得名的病毒还有轮状病毒、杯状病毒等。冠状病毒属于套式病毒目(Nidovirales)冠状病毒科 (Coronaviridae)。冠状病毒科病毒含有四个病毒属,分别为 Alphacoronavirus, Betacoronavirus, Deltacoronavirus以及 Gammacoronavirus。高致病性的冠状病毒SARS-CoV和MERS-CoV,以及用于研究冠状病毒分子病毒学的模式病毒MHV均属于Betacoronavirus。这种病毒的基因组是一条单股正链RNA,长度约为30,0000个核酸,属于基因组最大的RNA病毒之一。这个基因组既可以作为信使RNA(mRNA)翻译成蛋白质,也可以作为模版合成负链RNA。不同于很多正链RNA病毒,套式病毒目的病毒以基因组为模版合成亚基因组负链RNA(subgenomic RNA),然后再以亚基因组负链RNA为模版合成亚基因组正链RNA,它们可以做为信使RNA翻译成病毒的各种蛋白质[2]。
二、SARS病毒
severe acute respiratory syndrome coronavirus (SARS-CoV)
说起非典,会勾起不少人的回忆。大概2002年底到2003年初,一种传染性的肺炎悄无声息地在广东开始传播。很快,这种传染性肺炎就传播到了中国的多个省份。由于在本地无法治愈,一些病人从中国其他省份来到北京寻求治疗。在几个月时间内,这种疾病就传播至台湾、新加坡、越南、泰国、马来西亚、印尼、加拿大、澳大利亚、俄罗斯、巴西、法国、英国、西班牙、波兰、德国、瑞典、芬兰、南非等多个国家和地区[3]。世界卫生组织把这种肺炎称为急性呼吸窘迫综合症(severe acute respiratory syndrome (SARS) ),香港媒体把这种传染病音译为沙斯,坊间传言,中国大陆人士认为“沙斯”和“杀死”音同,因此最终定名为非典型性肺炎,简称非典。
医生注意到,非典可以通过飞沫传播,病人咳嗽或打喷嚏,可以向空气中释放大量携带病原体的飞沫,并通过呼吸道传染给健康人群,因此非常容易出现聚集性感染,并给医护人员带来很高的感染风险。非典的暴发成为一个举世瞩目的大事件,美国时代周刊 (亚洲) 有一期的封面是一个中国国旗为背景的胸透图片。中国缺乏应对大规模呼吸道传染病的经验,加之病例在急剧增加,非典在中国有燎原之势,许多海外媒体认为中国的应对缓慢,信息发布不及时。一时间,诸如“中国向世界输出传染病”“世界应该隔离中国”的论调甚嚣尘上。更雪上加霜的是,中国的病毒性传染病研究比较薄弱,而人类对冠状病毒知之甚少,给鉴定病原体带来不少困难。
01 发现病原体
找到非典的病原体意义重大,诊断、治疗及预防都靠它指明道路。所谓对症下药,只有知道了病因才有可能找到有效的治疗方案。在非典的起源地,广东省的医生和科学家试图找到导致非典的元凶,他们排除了鼠疫、禽流感、炭疽等常见病原体,但是没有成功分离到细菌或病毒。医生们发现,对病人使用抗生素治疗没有效果,他们怀疑病原体是一种病毒,而不是细菌,抗生素可以杀死细菌,对病毒却是无效的。
中国疾控中心从广东省取得病人的病理学样本后,想通过电镜来鉴别出可能的病原体。当时,中国电镜领域一位权威微生物学家所领导的团队发现病人组织的电镜图像中显示出清晰的支原体形态,据此推断这种肺炎可能是衣原体导致的[4, 5]。2003年2月18日,中央电视台及新华社向公众发布消息,称中国科学家已经发现了导致非典的病原体是一种衣原体,不是难以对付的病毒。我们已经无从得知,为什么中央电视台和新华社会匆忙发布一条未经仔细检验的信息。根据《科学》杂志(Science)2003年7月的报道,时任中国科学院副院长的陈竺院士对《科学》杂志说“他们阻止别的专家对此发表意见”[6]。央视和新华社的结论出来之后,有些广东的科学家和医生对此结论持有怀疑态度,这其中最著名的代表就是工程院院士钟南山[4, 5]。他坚持认为导致非典的是一种病毒,质疑央视和新华社发布的结论,如果是衣原体,抗生素治疗应该是有效的,而临床经验表明抗生素治疗无效[5]。其间还有香港中文大学发布新闻,认为非典的病原体是一种副黏病毒[5]。
与此同时,全世界其他地区的科学家也加入了寻找病原体的大军。2003年3月25日,香港大学医学院的Malik Peiris 教授领衔的团队与香港其他医院与科研机构合作向世界卫生组织报告,并向媒体通报,他们在在香港病人的样品中分离并检测到了冠状病毒,并将研究报告发布表在了2003年4月份出版的著名医学期刊《柳叶刀》上,随后德国、美国、加拿大的科学家也发表了他们的研究结果,他们得出了与香港科学家类似的结论,导致非典的病原体可能是一种冠状病毒[1, 7]。
为什么科学家这么谨慎?为什么鉴定一个疾病的病原体这么困难?这就要回到科赫法则了(Koch postulates,也称柯赫准则)——这一法则被誉为判断一种传染病病原体的“理想黄金法则”。举个例子,比如一个人今天吃了一根胡萝卜,第二天他感冒了,然后就推导出吃胡萝卜导致感冒,听起来是不是挺可笑的?同样的道理,传染病的病原体甄别也是一样的:一个人得了非典,会在他体内检测到多种病原体,又因为并发感染并不少见,所以即使从病人体内检测到了衣原体,也不能100%确定是衣原体感染导致了肺炎。19世纪的德国微生物学家科赫(Robert Koch)在研究细菌感染的过程中,提出了一套准则来判断一种细菌是否是导致一种疾病的病原体:
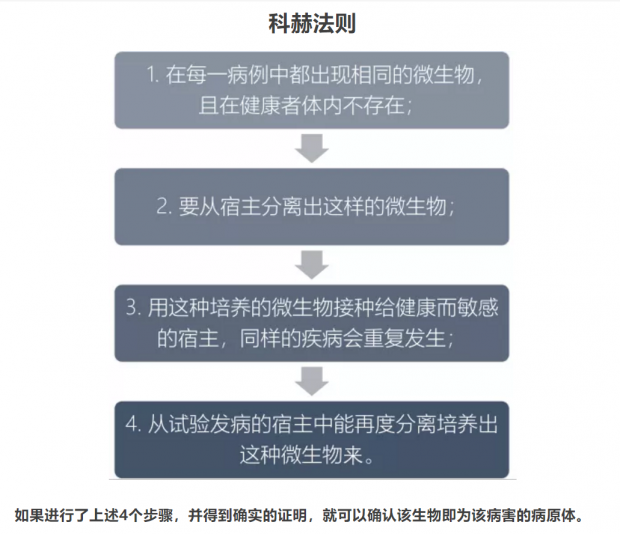
如果将科赫法则套用到非典的病原体鉴别上,就需要满足:
1)从非典患者中检测到了SARS病毒,而SARS病毒在健康患者中不存在;
2)能够从患者体内分离出SARS病毒,而且可以在体外培养。
3)把分离到的SARS病毒接种给健康的人,会导致非典;
4)从发病的接种患者体内再次分离到SARS病毒。
由此可见,科赫法则是非常理想化和苛刻的,很多实际情况并不能完全满足科赫法则。我们不能够拿活人去做实验接种SARS病毒,看健康人感染了病毒会不会得非典。科学家们发现有一种替代的方法:一般而言,病毒感染人,会激发人体产生中和这种病毒的抗体(抗体反应比较特异),如果用非典病人的血清稀释4倍以上,还可以中和分离出来的SARS病毒,基本上就能够认定是SARS病毒导致了非典。
如果按照这个法则,我们可以看到,中国疾控中心发布的结果问题出在哪里:该结果满足了第一条,通过电镜,在数个非典病人的样品中发现了衣原体。但是,就像上面所举的例子,在病人体内检测到衣原体并不能100%意味着病人的症状是感染衣原体导致的。对比来看,Malik Peiris教授领导的团队从非典病人体内分离到了病毒,用电镜发现这是一种冠状病毒,然后用核酸检测的方式,发现50个非典病人中,有45个呈SARS病毒核酸阳性。这就为确认SARS病毒是非典病原体打下了坚实的实验基础[1, 7]。后来Ralph Baric教授实验室建立了SARS病毒的小鼠感染模型,把SARS病毒接种到健康小鼠身上,健康小鼠会出现跟人类似的非典症状,然后又可以从新感染的小鼠肺部分离到SARS病毒[8]。他们的做法基本上完全满足了科赫法则的条件。
中国科学家在当时完全没有能力鉴定出SARS病毒是非典的病原体吗?答案是否定的。中国大陆有科学家早于香港科学家分离鉴定了SARS病毒。根据《科学》杂志报道,2003年2月14日,军事医学科学院的杨瑞馥和朱庆余研究员领导的团队从广东拿到了病人样品,22日从样品中分离到了病毒,26日通过电镜观察,他们发现这种病毒是一种冠状病毒。通过病人的血清中和实验,后续的工作发现,非典病人血清可以中和分离到的病毒。报道称,由于杨瑞馥团队只有少量的病人血清,所以他们不敢断言这种冠状病毒就是导致非典的病原体,杨瑞馥觉得没有足够的信心去挑战一个知名权威做出的鉴定结果[6]。在此期间,华大基因(中国科学院基因组研究所)试图参与发现病原体的研究,但是不能够得到病人样品[6]。
从SARS病毒的发现过程来看,信息公开,协同合作至关重要。假如军事医学科学院可以有更多样品,他们有很大可能早先发现并确定病原体。或者,华大基因如果能够拿到样品,他们也可以为病原体鉴定做出贡献。遗憾的是,不知道出于什么原因,他们都无法拿到(足够多的)样品。还有一点非常重要,就是不要匆忙发布一个影响巨大的结果。显然,中国疾控中心的科学家们在鉴定非典病原体时没有很好的遵循科赫法则,以致给出了一个错误的结果。这个错误结论所引发的后果,就是全国各个医院都根据这个结果,按照衣原体感染的治疗方法来治疗非典病人[5]。
鉴定出病原体之后,病毒的传播途径也搞清楚了:通过飞沫传播。随后,中国政府改进了信息采集和通报机制,努力做到疫情信息的准确公开透明。这让许多谣言失去了传播的温床,更增强了民众对控制疫情的信心。解放军在北京小汤山建立野战级别的医院,集中收治在北京的患者。经过广大医务人员的不懈努力,2003年7月,世界卫生组织将中国大陆从非典疫区中除名。在此次疫情控制中,有超过100名医护人员感染,其中35人殉职[9]。
02 后续研究进展
非典疫情结束之后,在台湾、新加坡和中国大陆又出现4次实验室感染事故[10]。幸好控制及时,才没有造成大规模暴发。出现实验室感染之后,中国大陆停止了SARS病毒的研究工作。世界上还有为数不多的实验室继续从事活病毒的研究工作,主要集中在美国和欧洲。
现今担任北京生命科学研究所研究员的李文辉,2003年在美国工作期间与其合作者发现了SARS病毒感染宿主所使用受体ACE2蛋白,后来的研究又发现一些类似于SARS的冠状病毒也使用同样的受体,这些发现为研究病毒的跨物种传播起到了重要的作用[11, 12]。
同年,北卡罗来纳大学教堂山分校的Ralph Baric教授实验室利用建立MHV反向遗传系统的经验,迅速建立了SARS病毒的反向遗传系统,为研究病毒的复制感染等提供了强大的分子病毒学平台[2]。
荷兰科学家Osterhaus带领的团队发现,家猫和雪貂都可以感染和传播SARS病毒。2004年在中科院生物物理研究所和清华大学工作的饶子和院士带领的团队,解析出病毒最主要的结构蛋白Spike的部分晶体结构。也是在2004年,瑞士科学家Antoniao Lanzavecchia带领的团队,利用当时最新的B细胞永生化及抗体技术,从康复的非典病人的B细胞中克隆到了能够中和SARS病毒感染的人源抗体,这种抗体为应对将来的SARS病毒感染提供了可行的治疗方法。2007年,美国NIH 的Kanta Subbarao团队与Ralph Baric 团队合作建立了SARS病毒的小鼠感染模型,为研究病毒的致病机理提供了重要的感染模型[8, 13]。
这些都是SARS病毒研究领域的里程碑式的成就。预防病毒性传染病最有效的方法是疫苗,虽然科学家们研发了各种疫苗,但是没有一种疫苗最终成为产品被批准上市。这其中最重要的原因还是经济因素,从制药公司的角度,他们不太可能愿意投入巨额资金去研发一种看起来市场前景不大的疫苗。在这次疫情之后,SARS病毒再也没有大规模传播,除个别实验室有后续偶发感染外,再不见其他报告,曾肆虐一时的可怕病毒,就这样消失在公众的视线当中。
03 追踪溯源
但科学家们仍旧关心这个问题:SARS病毒是从哪里来的?是从哪一个物种传播给了人类?
病原体的宿主,大体可分为三类:
天然宿主:是指天然携带某种病原体的宿主,病原体可以在宿主体内维持复制,但是不会导致宿主发病,并且能够向其他物种传播这种病原体。
中间宿主:是指天然不携带某种病原体,但是可以被天然宿主携带的病原体感染,并可以向其他物种传播病原体的宿主。
终末宿主:可以被天然宿主或中间宿主携带的病原体感染,但是不会向其他物种传播这种病原体的宿主。
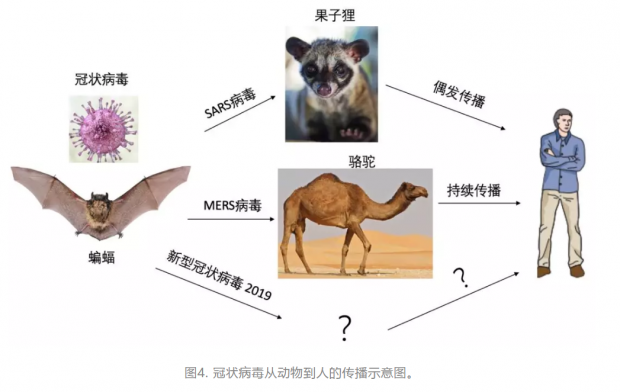
在追踪SARS病毒来源的过程中,人们最先怀疑果子狸是病毒的最初来源,因为初始病例大多数有接触过果子狸的经历,科研人员从野生动物市场上的果子狸体内检测到了SARS病毒的核酸。进一步的研究发现,果子狸跟人一样,被SARS病毒感染后会患病。更大规模的筛查发现,果子狸养殖场的果子狸和野外生活的果子狸都没有感染过SARS病毒[14]。这些结果表明,果子狸很可能是一种中间宿主,它并非SARS病毒的源头。人们也并不能排除这么一种可能性:野生动物市场的果子狸是被人类传染的,而不是它们把病毒传染给人类的。
时间推到1995年,科学家在澳大利亚发现了一种可以感染马和人的病毒:Hendra 病毒。这是一种极其致命的病毒,被列为最高生物安全等级的四级病原体,跟大家更熟知的埃博拉病毒一个等级。1996年,澳大利亚通过物种血清筛查,发现一种蝙蝠的血清可以中和Hendra病毒。这项结果提示,蝙蝠可能感染过这种病毒。2000年,澳大利亚的科学家终于在蝙蝠体内分离到了这种病毒,最终蝙蝠被认定为Hendra 病毒的天然宿主。不久之后,另一种极其致命的病毒——尼帕病毒——也被认为是由蝙蝠携带和传播的。科学家有理由怀疑,冠状病毒也有可能是由蝙蝠携带传播的[15]。
2005年,中科院动物所张树义研究员与武汉病毒所研究员石正丽以及澳大利亚的王林发教授合作在《科学》杂志发表的论文称,在蝙蝠体内检测到一种类似于SARS病毒的冠状病毒的核酸,但是并没有分离到病毒[16]。随后的几年里,石正丽团队在这个领域不断突破,2013年,她带领的团队在《自然》杂志发表一项研究,在云南的一个蝙蝠栖息洞中,科学家在菊头蝠的粪便中分离到一株类似于SARS病毒的活病毒,这种新分离的病毒与已知的SARS病毒具有高度同源性,可以利用ACE2蛋白做为受体感染人的细胞[11]。这项研究清晰地揭示了SARS病毒的来源,石正丽教授的团队在这个地区的蝙蝠种群中检测到了组装SARS病毒所需要的所有基因[17]。他们推断,SARS病毒很大可能是由感染蝙蝠的各种“类SARS病毒”重组而来,在偶然的情况下,果子狸感染了这种病毒,病毒在果子狸体内进行了复制与进化,通过被人捕猎的方式最终把病毒传播给了人类[18]。
三、中东呼吸道病毒
Middle East respiratory syndrome coronavirus (MERS-CoV)
SARS病毒消失接近10年之后,大约在2012年,一种未知原因的肺炎在中东地区出现,同年9月,沙特阿拉伯和荷兰科学家合作,在沙特一个因急性肺炎死亡的病人样品中分离到一种冠状病毒,起初这种病毒被命名为HCoV-EMC (得名于发现这个病毒的荷兰 Erasmus Medical Center) ,后来WHO以它的流行起源地中东来正式命名这种病毒为“中东呼吸道病毒”(MERS病毒)[19]。通过序列分析,科学家发现,这种病毒在进化上与此前发现的蝙蝠相关的冠状病毒(HKU4、HKU5,由香港大学的科学家发现和鉴定)有高度同源性。他们发现这种病毒导致的疾病症状与2003年爆发的SARS 病毒非常相似[19]。
起初,由于这种疾病在中东只有零星的感染病例,并未出现大规模流行,医生和疾病控制部门认为MERS 病毒人传人的概率较低,不会像SARS病毒那样极易形成密集感染[20]。然而,2015年,一个韩国人去中东地区旅行回到韩国后被诊断为MERS,在不长的时间里,这一个病人直接或间接导致了186人感染[20]。这个例子说明,冠状病毒的人际传播是不可忽视的风险。从WHO网站统计的结果来看,截至2019年11月,全世界共有27个国家或地区发现了MERS病毒感染病例,病患人数达到2494例,死亡858例。由此看来MERS病毒导致的死亡率约为30% ,远远高于SARS病毒10%的患者死亡率。
而且,不像SARS病毒在2013年消失之后,除中国在2014年出现过少量实验室感染之外,再也没有人感染SARS病毒的病例出现,MERS病毒的感染则是一直以一种低流行度在中东地区传播,偶然有感染MERS病毒的病例通过国际旅行将病毒带入其他地区[20]。2015年5月,一位韩国感染者来到中国,成为中国第一位输入性病例[20]。中国积极地应对了这次输入性病例可能带来的风险,隔离了患者,并密切观察了38名接触者,成功阻断了病毒在中国的传播。
与SARS病毒类似,MERS病毒也是由动物传播给人的。许多患者都有接触骆驼或食用骆驼制品的经历。2013年科学家发现,在中东和北非地区的骆驼有相当一部分比例呈现抗MERS 病毒血清阳性,说明这些骆驼都感染过MERS 病毒。2014年,科学家从骆驼样品中分离出了MERS病毒,证实了这种感染的持续存在;骆驼感染的MERS病毒和从人的样品中分离到的病毒高度同源,说明了骆驼是向人传播的一种中间宿主[21]。
由于之前中国科学家已经证实蝙蝠是SARS病毒的来源,这一次科学家也试图在中东和北非的蝙蝠中寻找MERS病毒。也是在2014年,科学家在南非的一种蝙蝠粪便中检测到一种与人感染的MERS病毒高度同源的冠状病毒,这种病毒被认为是目前流行毒株的早期祖先株[22]。由此看来,SARS的研究为追踪研究MERS带来了很好的基础,让科学家没有像早期研究SARS那样经历诸多困惑和难题,这是科学进步带来的。由于MERS病毒通过骆驼传播,骆驼在中东和北非属于重要的经济动物,时至今日,病毒还在以低流行度传播着,因此有必要研发一种MERS病毒疫苗。
四、新型冠状病毒2019
(2019-nCoronavirus)
2019年底,武汉市卫生健康委员会向当地医疗机构下发了一份“关于报送不明原因肺炎救治情况的紧急通知”的红头文件。随后,媒体相继跟进报道,更多细节逐渐曝出。据报道,当时所有已知病例都跟武汉华南海鲜市场有关,他们要么是市场工作人员,要么是经常去市场采购的人员。后又有报道称,这个市场不仅仅卖水产品,也存在一些野生动物交易。这一未经证实的细节留给人们许多想象的空间。因为,目前还没有发生过水产品向人传播肺炎的案例,而SASR病毒一直被认为是从蝙蝠传播到野生果子狸,然后传播给人的。如果事发的武汉海鲜市场存在野生动物交易,就存在野生动物携带某种病原体传播给人的可能性。

图5. 2019年12月30日起在网上流传的武汉卫健委红头文件。
2020年1月9日,以中国疾控中心徐建国教授为组长的团队通过央视向公众发布了不明原因肺炎的最近研究进展。他表示,其团队于1月7日从一个病人样品中分离到了一种冠状病毒,这一结果通过电镜的病毒形态观察和病毒基因组测序结果得到了验证。研究人员从15名被诊断为不明原因肺炎的患者样品中检测到了新型冠状病毒的核酸,由此进一步证实了科学家们的发现。此前,医生和科学家认为这是一种病毒性肺炎,而武汉和北京的团队排除了是SARS、MERS、禽流感等已知病毒的可能性。通过序列分析,徐建国团队的科学家认为这是一种新型的冠状病毒,这种病毒跟此前已经分离到的蝙蝠携带的类SARS病毒有较高的同源性[23]。
1月10日,参与病原体分离鉴定的复旦大学公共卫生中心的张永振教授团队在网站上发布了病毒的全基因组序列,得到国际社会一致赞扬。及时分享病毒基因组序列对全世界的科学家和公共卫生组织来说至关重要,可以迅速推进研究,为诊断试剂的研发和病毒致病性研究提供重要的材料和依据。据《科学》网站报道,在中国科学家公布病毒基因组序列的同一天, Ralph Baric教授实验室就开始着手构建新型冠状病毒反向遗传系统的工作,这种系统可以让科学家用已经发布的序列,通过全基因组人工合成的方式在实验室把新型冠状病毒培养出来,而不需要从中国或其他国家进口活病毒。这省去了繁琐的行政程序,还可以让科学家用这种系统进行遗传操作来研究病毒的致病性以及研发一种疫苗[24]。
据纽约时报报道,美国从1月17和18日起,已开始筛查从纽约、旧金山和洛杉矶入境的来自武汉的游客。路透社援引自世界卫生组织的报告称,新型冠状病毒存在人传人的可能,有家庭聚集性感染出现。因此,防控还是一项非常紧要的任务。冠状病毒作为一种RNA病毒,虽然病毒基因组复制的保真度相对较高,但是也不能排除在病毒与宿主相互作用中出现毒力和传播能力更强的毒株。
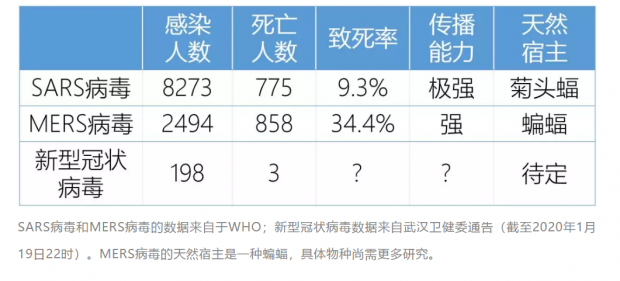
到目前为止,这种新病毒还有几大疑惑待解:
病毒会通过气溶胶和飞沫传播吗?
是什么动物把病毒传播给了人?
蝙蝠是新型冠状病毒的天然宿主吗?
这种新型病毒的传播途径是不是也是像SARS和MERS一样,从蝙蝠传播到新物种然后再传染给人的?
病毒是利用什么受体感染宿主细胞的?
回答这些问题,对疾病防控至关重要,我们期待中外科学家能够解开这些谜团。
五、应对新发传染病
20世纪末,人类在澳大利亚和东南亚分别发现过两种非常致命的病毒,Hendra 和尼帕病毒。进入21世纪,冠状病毒成为人类健康的新威胁。SARS、MERS和新型冠状病毒的暴发,说明新发传染病的持续性出现已经成为常态。而已知的非常致命的埃博拉病毒,自2013年在西非地区肆虐后,已经导致2万多人感染,1万多人死亡。非常相似的是,除尚待研究的新型冠状病毒,以上提到的这些疾病都是人畜共患病,它们的天然宿主都是蝙蝠[25]。除了上述感染人的病毒,人类在2018年发现并鉴定了一种对猪造成严重威胁的冠状病毒SADS病毒,而SADS病毒的源头也是蝙蝠[26]。持续的从蝙蝠到人和家畜的病毒传播不是偶然的——随着人口的不断增加,人为的自然环境破坏日趋严重,蝙蝠的栖息地遭到破坏,这些都可能是蝙蝠向其他物种传播病毒的原因。
蝙蝠何以成为“百毒之王”?蝙蝠如何耐受对人高致病性的病原体?这些病原体如何影响了蝙蝠的进化?这是科学家很想知道答案的几个大问题。蝙蝠是世界上种群最大的哺乳动物,也是唯一一种具有飞行能力的哺乳动物。需要知道的是,不同种群的蝙蝠会携带各种高致病病原体。例如,SARS病毒的天然宿主是菊头蝠,MERS病毒的天然宿主是另一种蝙蝠,而类似于埃博拉病毒的马尔堡病毒,其宿主是埃及果蝠[25]。
早先在澳大利亚从事研究工作,现就职于杜克-新加坡国立大学医学院的王林发教授是研究“蝙蝠作为病毒传播载体”的先驱,他的研究主要集中于黑果蝠(black fruit bats),这种蝙蝠可以传播Hendra病毒。他领导的团队发现,黑果蝠cGAS-STING(识别细胞质DNA以产生抗病原的干扰素)的系统不如人的系统效率高,而一个重要的炎症小体同路蛋白AIM2,在蝙蝠群体中是缺失的。与此同时,蝙蝠的细胞能通过高表达热休克蛋白,提高细胞对高体温的耐受性。一般而言,哺乳动物的干扰素表达是受到严格调控的,而王林发教授的团队发现,果蝠存在着一些持续性表达的干扰素基因[27]。这些特征都赋予蝙蝠独特的免疫性能。这些独特的性能与蝙蝠是“很多高致病性的病原体的天然宿主”究竟有多大程度的关联,还需要更进一步的研究。
人类该如何应对新发传染病?
在政府层面:首先,人类要学会尊重自然,保护环境,保护蝙蝠的栖息地不受破坏,减少人群和家畜跟蝙蝠接触的机会,加强立法和执法来禁止野生动物贸易。其次,疾病暴发时,增强疫情信息的透明度可信度和及时性,加强国内和国际合作,利用各种资源来鉴别病原体,让国际社会共同参与。第三,加强对传染病的基础研究的资助力度,增进人类对病毒的认识。
在研究层面:首先,可以考虑建立团队,对野生动物资源和家畜进行全国范围内的常态化,周期性的病原体检测和筛查,做好早期的防范和预警工作。其次,允许科学家进行已知病毒的增强毒力或增强传播能力的探索性研究。第三,建立新发传染病的疫苗技术储备,为应对新发传染病及时提供预防手段。
参考文献
[1] Hilgenfeld, R. & Peiris, M. From SARS to MERS: 10 years of research on highly pathogenic human coronaviruses. Antiviral Res 100, 286-295, doi:10.1016/j.antiviral.2013.08.015 (2013).
[2] Almazan, F. et al. Coronavirus reverse genetic systems: infectious clones and replicons. Virus Res 189, 262-270, doi:10.1016/j.virusres.2014.05.026 (2014).
[3] Boulos, M. N. Descriptive review of geographic mapping of severe acute respiratory syndrome (SARS) on the Internet. Int J Health Geogr 3, 2, doi:10.1186/1476-072X-3-2 (2004).
[4] 郝俊. 钟南山洪涛的“非典型”学术之争. 中国科学报 (2013).
[5] 廖怀凌. 诚实的胜利 非典病原体确认为冠状病毒始末. 人民网 (2003).
[6] Enserink, M. SARS in China. China's missed chance. Science 301, 294-296, doi:10.1126/science.301.5631.294 (2003).
[7] Peiris, J. S. et al. Coronavirus as a possible cause of severe acute respiratory syndrome. Lancet 361, 1319-1325, doi:10.1016/s0140-6736(03)13077-2 (2003).
[8] Roberts, A. et al. A mouse-adapted SARS-coronavirus causes disease and mortality in BALB/c mice. PLoS Pathog 3, e5, doi:10.1371/journal.ppat.0030005 (2007).
[9] SARS期间殉职医护人员列表. 维基百科.
[10] 赵鲁. 实验室SARS病毒泄漏事故回顾. 中国科学报 (2014).
[11] Ge, X. Y. et al. Isolation and characterization of a bat SARS-like coronavirus that uses the ACE2 receptor. Nature 503, 535-538, doi:10.1038/nature12711 (2013).
[12] Li, W. et al. Angiotensin-converting enzyme 2 is a functional receptor for the SARS coronavirus. Nature 426, 450-454, doi:10.1038/nature02145 (2003).
[13] Traggiai, E. et al. An efficient method to make human monoclonal antibodies from memory B cells: potent neutralization of SARS coronavirus. Nat Med 10, 871-875, doi:10.1038/nm1080 (2004).
[14] Wang, L. F. & Eaton, B. T. Bats, civets and the emergence of SARS. Curr Top Microbiol Immunol 315, 325-344, doi:10.1007/978-3-540-70962-6_13 (2007).
[15] Eaton, B. T., Broder, C. C., Middleton, D. & Wang, L. F. Hendra and Nipah viruses: different and dangerous. Nat Rev Microbiol 4, 23-35, doi:10.1038/nrmicro1323 (2006).
[16] Li, W. et al. Bats are natural reservoirs of SARS-like coronaviruses. Science 310, 676-679, doi:10.1126/science.1118391 (2005).
[17] Hu, B. et al. Discovery of a rich gene pool of bat SARS-related coronaviruses provides new insights into the origin of SARS coronavirus. PLoS Pathog 13, e1006698, doi:10.1371/journal.ppat.1006698 (2017).
[18] 张渺. “蝙蝠女侠”团队找出SARS病毒源头. 中国青年报 (2017).
[19] Zaki, A. M., van Boheemen, S., Bestebroer, T. M., Osterhaus, A. D. & Fouchier, R. A. Isolation of a novel coronavirus from a man with pneumonia in Saudi Arabia. N Engl J Med 367, 1814-1820, doi:10.1056/NEJMoa1211721 (2012).
[20] Baharoon, S. & Memish, Z. A. MERS-CoV as an emerging respiratory illness: A review of prevention methods. Travel Med Infect Dis, 101520, doi:10.1016/j.tmaid.2019.101520 (2019).
[21] Kandeil, A. et al. Middle East Respiratory Syndrome Coronavirus (MERS-CoV) in Dromedary Camels in Africa and Middle East. Viruses 11, doi:10.3390/v11080717 (2019).
[22] Memish, Z. A. et al. Middle East respiratory syndrome coronavirus in bats, Saudi Arabia. Emerg Infect Dis 19, 1819-1823, doi:10.3201/eid1911.131172 (2013).
[23] 屈婷. 武汉不明原因的病毒性肺炎疫情病原学鉴定取得初步进展. 新华社 (2020).
[24] Cohen, J. Chinese researchers reveal draft genome of virus implicated in Wuhan pneumonia outbreak. Science (2020).
[25] Wong, G. et al. MERS, SARS, and Ebola: The Role of Super-Spreaders in Infectious Disease. Cell Host Microbe 18, 398-401, doi:10.1016/j.chom.2015.09.013 (2015).
[26] Zhou, P. et al. Fatal swine acute diarrhoea syndrome caused by an HKU2-related coronavirus of bat origin. Nature 556, 255-258, doi:10.1038/s41586-018-0010-9 (2018).
[27] Wang, L. F. & Anderson, D. E. Viruses in bats and potential spillover to animals and humans. Curr Opin Virol 34, 79-89, doi:10.1016/j.coviro.2018.12.007 (2019).
版权说明:欢迎个人转发,任何形式的媒体或机构未经授权,不得转载和摘编。转载授权请在「返朴」微信公众号内联系后台。
话题:
0
推荐
财新博客版权声明:财新博客所发布文章及图片之版权属博主本人及/或相关权利人所有,未经博主及/或相关权利人单独授权,任何网站、平面媒体不得予以转载。财新网对相关媒体的网站信息内容转载授权并不包括财新博客的文章及图片。博客文章均为作者个人观点,不代表财新网的立场和观点。




 京公网安备 11010502034662号
京公网安备 11010502034662号 