阅读:0
听报道
像SARS、MERS和新型冠状病毒这一类的病毒,存在于自然界,除人类之外还有其他的宿主,即使有疫苗,我们也可能永远无法将其消除。遏止吃野味的陋习、加强市场管理和检疫、提高人们的公共卫生意识,才是避免灾难再次发生的关键。
撰文 | 李大鹏(Duke University)
世界上第一支疫苗诞生于18世纪末的英国。英国医生爱德华·詹納 (Edward Jenner) 注意到感染过牛痘病毒的挤奶女工不会感染天花,于是推测牛痘病毒可以预防天花。通过实验他证明了牛痘病毒接种可以有效预防天花病毒感染。1881年,法国科学院院士路易·巴斯德 (Louis Pasteur) 纪念詹納,提议根据拉丁语“Variolae vaccinae (牛痘) ”将这种预防接种制剂命名为“Vaccine” (疫苗) ,并这一过程命名为“Vaccination” (疫苗接种) [1]。
二百多年来,科学家们相继发明了针对狂犬、结核、小儿麻痹症等几十种传染性疾病的疫苗。最开始的疫苗是将病毒用甲醛等进行灭活处理,使其失去感染力,称之为灭活疫苗,例如小儿麻痹症 (脊髓灰质炎病毒) 疫苗、狂犬疫苗、甲肝疫苗等。另外,毒力减弱的病毒或细菌也被用作疫苗,例如麻疹疫苗、风疹疫苗、结核疫苗 (也就是我们所熟知的“卡介苗”) 等,被称为减毒活疫苗。尽管当时人们并不完全清楚疫苗如何保护机体免受病原感染,但随着免疫学和微生物学技术手段进步,科学家们逐渐认识到,预防性疫苗通过诱导机体产生特异性免疫反应,从而起到预防疾病的效果。
后来,分子生物学技术的发展促使更安全的亚单位疫苗被发明出来,所谓亚单位疫苗,是指对一个病毒或细菌,只利用其中的有效成分——往往是1-2个蛋白——来诱导机体产生免疫保护。我们熟知的乙肝疫苗、宫颈癌疫苗就是亚单位疫苗的成功典范。
以上三类疫苗涵盖了目前上市的绝大多数细菌和病毒疫苗。此外,随着基因工程技术的发展,DNA疫苗、mRNA疫苗以及病毒载体疫苗等新型疫苗也逐渐崭露头角,多种有希望的候选新型疫苗都正处于临床试验阶段。
尽管人们已经对疫苗有了深入了解,还是有很多传染性疾病难以被人类攻克。最具有挑战性的莫过于人类传染病领域的“Big 4”:艾滋病 (HIV)、流感 (influenza virus)、结核 (M. tuberculosis)、疟疾 (malaria)。仅美国政府每年就投入数十亿美元用于这4种病原体的研究 [2],然而除了流感病毒每年有季节性流感疫苗以外,其他疫苗的开发依然举步维艰。随着近年来免疫学、基因组学和蛋白组学的进步,人们试图解答一个问题:为什么有些疫苗难做,有些疫苗却相对容易?
经典疫苗研制成功的关键
简言之,打一针可以保护一辈子的疫苗是理想的疫苗。例如麻疹、风疹和流行性腮腺炎疫苗都可以通过一针免疫实现十年以上的保护效力。其中,麻疹疫苗更是对96%的接种者都能够实现终身保护[3]。脊髓灰质炎病毒疫苗,也就是很多人小时候吃过的“糖丸”,已经接近实现全球范围内脊髓灰质炎的消除。亚单位疫苗中,乙肝疫苗是最经典的成功案例,它的有效成分为乙肝表面抗原 (HBsAg) ,通过三针免疫,有效性可达80%-100%,可以提供长达20年以上的保护[4]。
以上这些长效的病毒疫苗往往具有一个共同的特点,就是通过诱导机体产生中和抗体来抵御病毒的入侵。对于急性感染的传染病来说,这一点显得尤为重要。
具体来说,长效疫苗可以诱导人体的免疫系统产生出长效浆细胞和记忆B细胞。长效浆细胞可以长期产生抗体;记忆B细胞虽然不直接制造抗体,但可以长期保持对该病毒的“记忆”,一旦发生病毒入侵,记忆B细胞就会被激活产生浆细胞,从而分泌大量中和抗体来对抗病毒。中和抗体可以紧紧附着在病毒表面,阻止病毒与人体细胞结合(图1);有的中和抗体即使在病毒与细胞发生接触以后,仍然可以阻断病毒释放遗传物质进入细胞,从而防止病毒感染。
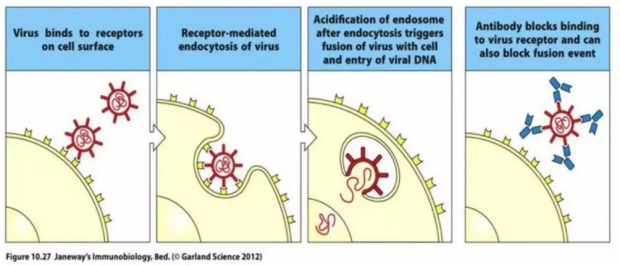
图1. 中和抗体阻断病毒感染示意图。图中红色表示病毒,黄色表示细胞,细胞表面黄色突出状表示细胞表面受体。病毒感染过程中首先通过膜蛋白与细胞表面受体结合(A),之后通过细胞内吞作用进入细胞(B) ,随后释放遗传物质进入细胞(C)。当体内存在中和抗体时,中和抗体可以紧密结合在病毒膜蛋白表面,从而阻止病毒与细胞受体结合(D)。图片来源自Janeway's Immunobiology, Ninth Edition.
一项研究表明,注射乙肝疫苗免疫30年后,再进行一针免疫,有88%的受试者可以产生高滴度的抗体,这证明乙肝疫苗诱导出的记忆B细胞可以提供长期保护[5]。另一个经典的案例是黄热病疫苗,YFV-17D,一针免疫40年后,接种者体内仍然存在特异性抗体[6]。目前,上市的绝大多数病毒疫苗都是通过诱导高滴度的中和抗体来保护人体免受病毒感染。
为什么有些病毒我们开发不出疫苗?
第一是技术上的原因。
与上述经典疫苗相反,如果疫苗不能诱导特异性针对某种病毒的中和抗体,那么该病毒就很难通过疫苗免疫来预防。以艾滋病为例,尽管美国国立卫生院(NIH)每年投入约6亿美元经费用于研发HIV疫苗[7],目前的HIV候选疫苗依然难以在体内诱导中和抗体。首先,HIV候选疫苗容易诱导机体产生大量“非中和抗体”,这种抗体没有中和活性,因此无法抵御病毒感染细胞。其次,HIV病毒表面的结构蛋白带有大量的糖 (约和蛋白自重相等) ,人体内即使存在中和抗体,也难以通过重重阻隔,无法触碰到病毒。最后,能够产生中和抗体的B细胞往往被自身免疫系统误认为是过敏反应B细胞,从而在早期阶段就被扼杀在摇篮之中[8]。这些技术上的原因往往是病毒本身的性质所决定的。
第二是经济和社会学的原因。
疫苗需要通过临床前试验、I、II、III期临床试验证明安全有效才能上市,因此开发一种疫苗需要耗费大量的财力和人力。尤其是大规模III期临床实验,往往需要上万名受试者,持续3-5年时间,花费大约1.5亿~15亿美元[9],而且要承受失败的风险。因此,如果公司规模不够大,又没有政府参与和投入,一个制药公司往往难以承担如此昂贵的成本和如此高的风险。即使疫苗通过了III期临床试验得以上市,如果疾病的流行只是区域性的,那么未来该疫苗的市场有可能不足以收回成本。例如,中东冠状病毒 (MERS) 只在阿拉伯半岛和韩国短暂流行[10],因此,尽管目前MERS的疫苗已经上了I/II期临床试验,且效果可观,但预计完成整个临床试验直至疫苗上市可能还需要十年以上的时间[11]。
为什么新冠疫苗可以“拍着胸脯”讲能开发成功?
针对新型冠状病毒的疫苗,中国疾病预防控制中心主任高福院士在前不久接受采访时说:“大家知道,研发一个疫苗、研究一个疫苗是需要很长很长时间的,但是从我们过去对SARS或者对这一类病毒的认知,我可以拍着胸口讲,这个疫苗肯定会成功的。”[12]美国国立卫生院国家过敏和传染病研究所(NIAID)院长Anthony Fauci也向媒体宣布,NIAID将于mRNA疫苗巨头Moderna合作,希望在三个月将新型冠状病毒疫苗推向临床试验。[13] 为什么中美两国的高层科学家都对新型冠状病毒的疫苗开发信心十足呢?
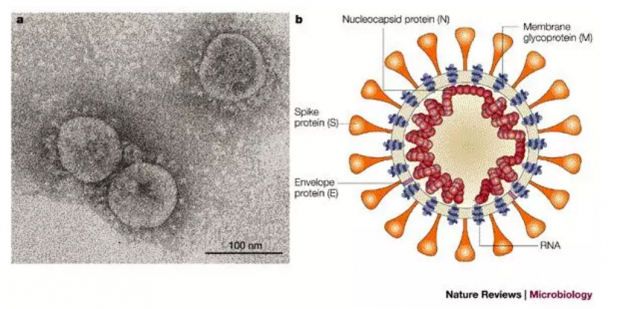
图2. SARS病毒在电子显微镜下呈现类似”王冠”状的形态(a),以及SARS病毒结构示意图(b). 棘突蛋白 (spike蛋白,又称S蛋白) 在a中可见于病毒表面,在b中用橙色标示。图片来自参考文献[14]
根据最近中科院武汉病毒研究所石正丽实验室发表的结果,新型冠状病毒的基因序列与SARS有79.5%的相似度,并且,和SARS病毒一样,是通过病毒的棘突蛋白 (spike蛋白,又称S蛋白;图2) 结合细胞表面的ACE2 受体来感染细胞的[15],这进一步说明,新型冠状病毒的S蛋白和SARS病毒的S蛋白具有十分相似的结构。因此,新型冠状病毒的疫苗开发可以借鉴SARS疫苗的研究。
根据SARS疫苗的临床前试验结果,可以看到它并不像HIV疫苗开发那样困难——基于全长S蛋白的病毒载体疫苗、亚单位疫苗和DNA疫苗都能在动物模型上诱导SARS中和抗体,并提供良好的保护效果[16]。如果进一步改造S蛋白,只截取其有功能的受体结合区,还有可能进一步降低疫苗毒性,并诱导出更高质量的中和抗体[17]。此前,高福领导的团队在SARS和MERS的S蛋白受体结合区的结构方面做出了很漂亮的工作[18],加深了研究人员对这一疫苗候选蛋白的了解。美国NIH疫苗研究中心 (VRC) 的Barney Graham和Gary Nabel团队开发的基于SARS病毒S蛋白的DNA疫苗也在动物实验和临床I期中取得了良好的效果[19-20]。相信这也是中美两国科学家对新型冠状病毒疫苗研制如此有信心的原因。
综上,开发新冠疫苗在技术上应该不会有太大难度。且目前的病例数量较多,易感人群更是数量巨大,不难招募到足够的志愿者参与临床试验。如果能尽快开发出新冠病毒的候选疫苗,并在动物模型上证明有效,相信国家会大力优先推进该疫苗的临床试验。不过,我们还是要牢记,即便技术上没有太大难度,政策上也一路绿灯,科学、严谨的临床试验也不可能在短期内完成。
任 重 道 远
事实上,要解决这次疫情,无论是中国还是美国都希望不需要走到使用疫苗这一步——我们希望这次疫情能够像非典一样,随着天气的转暖而消失。然而,那时南半球即将进入冬天,没有人能预测新冠病毒会如何蔓延发展。因此,开足马力加快新冠病毒的临床前研究和临床研究,仍然是对全人类健康最为有利的选择。
最后,天花和脊髓灰质炎的例子证明,安全有效的疫苗是消除疫情、甚至最终从地球上消除这些病毒的利器。然而,像SARS、MERS和新型冠状病毒这一类的病毒,存在于自然界,除人类之外还有其他的宿主,即使有疫苗,我们也可能永远无法将其消除。遏止吃野味的陋习、加强市场管理和检疫、提高人们的公共卫生意识,才是避免灾难再次发生的关键。
参考文献
[1] Pasteur L (1881). "Address on the Germ Theory". Lancet. 118 (3024): 271–72. doi:10.1016/s0140-6736(02)35739-8.
[2]
[3]
[4]
[5] Bruce MG, Bruden D, Hurlburt D, Zanis C, Thompson G, Rea L, et al. Antibody Levels and Protection After Hepatitis B Vaccine: Results of a 30-Year Follow-up Study and Response to a Booster Dose. J Infect Dis. 2016;214(1):16-22.
[6] Wieten RW, Jonker EF, van Leeuwen EM, Remmerswaal EB, Ten Berge IJ, de Visser AW, et al. A Single 17D Yellow Fever Vaccination Provides Lifelong Immunity; Characterization of Yellow-Fever-Specific Neutralizing Antibody and T-Cell Responses after Vaccination. PLoS One. 2016;11(3):e0149871.
[7] HIV Prevention Research & Development Investments, 2017.
[8] Haynes BF, Burton DR, Mascola JR. Multiple roles for HIV broadly neutralizing antibodies. Science Translational Medicine. 2019: Vol. 11, Issue 516, eaaz2686
[9] Black S. The costs and effectiveness of large Phase III pre-licensure vaccine clinical trials. Expert Rev Vaccines. 2015;14(12):1543-8.
[10]
[11] Yong CY, Ong HK, Yeap SK, Ho KL, Tan WS. Recent Advances in the Vaccine Development Against Middle East Respiratory Syndrome-Coronavirus. Front Microbiol. 2019;10:1781.
[12]
[13]
[14] Stadler K, Masignani V, Eickmann M, Becker S, Abrignani S, Klenk HD, et al. SARS--beginning to understand a new virus. Nat Rev Microbiol. 2003;1(3):209-18.
[15] Zhou et al. Discovery of a novel coronavirus associated with the recent pneumonia outbreak in humans and its potential bat origin. bioRxiv. 2020.
[16] Song Z, Xu Y, Bao L, Zhang L, Yu P, Qu Y, et al. From SARS to MERS, Thrusting Coronaviruses into the Spotlight. Viruses. 2019;11(1).
[17] Zhu X, Liu Q, Du L, Lu L, Jiang S. Receptor-binding domain as a target for developing SARS vaccines. J Thorac Dis. 2013;5 Suppl 2:S142-8.
[18] Yuan Y, Cao D, Zhang Y, Ma J, Qi J, Wang Q, et al. Cryo-EM structures of MERS-CoV and SARS-CoV spike glycoproteins reveal the dynamic receptor binding domains. Nat Commun. 2017;8:15092.
[19] Yang ZY, Kong WP, Huang Y, Roberts A, Murphy BR, Subbarao K, et al. A DNA vaccine induces SARS coronavirus neutralization and protective immunity in mice. Nature. 2004;428(6982):561-4.
[20] Martin JE, Louder MK, Holman LA, Gordon IJ, Enama ME, Larkin BD, et al. A SARS DNA vaccine induces neutralizing antibody and cellular immune responses in healthy adults in a Phase I clinical trial. Vaccine. 2008;26(50):6338-43.
版权说明:欢迎个人转发,任何形式的媒体或机构未经授权,不得转载和摘编。转载授权请在「返朴」微信公众号内联系后台。
话题:
0
推荐
财新博客版权声明:财新博客所发布文章及图片之版权属博主本人及/或相关权利人所有,未经博主及/或相关权利人单独授权,任何网站、平面媒体不得予以转载。财新网对相关媒体的网站信息内容转载授权并不包括财新博客的文章及图片。博客文章均为作者个人观点,不代表财新网的立场和观点。




 京公网安备 11010502034662号
京公网安备 11010502034662号 