阅读:0
听报道
昨日突然爆出的娱乐圈明星八卦,将“代孕”一词送上了热搜,大龄女性的生育焦虑也被再一次唤起。上世纪七十年代起,我国政府开始倡导晚婚晚育。到今天,女性的生育年龄结构已经发生了巨大的变化,许多城市女性担忧的是自己“年龄大了”,生孩子会不会危险,孩子生出来会不会健康。“高龄”女性面对生育难题,是该顺其自然,还是用助孕措施“逆天改命”?今天的文章将从遗传学的角度为大家解惑。
撰文 | 阿拉蕾(同济大学医学院内科学硕士) 晓蕊(上海交通大学医学院妇产科学博士)
近年来,女性生育年龄推迟已经成为一种较为普遍的现象,在大城市尤为突出。一方面,随着社会的发展,女性社会地位不断提升,接受教育以及外出工作的比例明显增加,生育观念也随之改变;另一方面,国家“二胎”政策全面放开,将有更多的80后、90后女性有“二胎”需求,生育年龄结构发生了巨大的变化。与此同时,“高龄”女性的生育能力、子代健康问题也备受关注。我们今天的话题,从一个真实的病例开始。
王女士婚后两次怀孕,都在3个月不到的时候,孩子莫名“没了”。她来到医院的生殖医学中心就诊,病史显示:
王女士,36岁,结婚3年,已有两次自然受孕。但是,在孕70天时,B超显示未见胎心,最后均行清宫术终止妊娠。第二次怀孕时行胚胎绒毛染色体检查,结果显示为16-三体综合征(注:就是指16号染色体多了1条,导致胎儿发育异常,自然流产)。女方染色体、男方染色体和精液检查均在正常范围。
王女士,36岁,结婚3年,已有两次自然受孕。但是,在孕70天时,B超显示未见胎心,最后均行清宫术终止妊娠。第二次怀孕时行胚胎绒毛染色体检查,结果显示为16-三体综合征(注:就是指16号染色体多了1条,能致胎儿发育异常,自然流产)。女方染色体、男方染色体和精液检查均在正常范围。
经全面分析后,医生为王女士实施了“三代试管”技术。首先,给予患者促排卵治疗,通过药物影响性激素水平,让原本要退化的卵母细胞也一起发育成熟,以取得更多成熟的卵母细胞。取得卵母细胞后,进行体外受精和体外培养,共获得4个外观正常的胚胎,取胚胎的部分细胞进行植入前遗传学检测,检测结果显示有2个胚胎是推荐移植的。随后,将其中1个正常胚胎移植入患者子宫后成功妊娠。
这个病例可以看作是部分“高龄”女性生育问题的缩影,其中包含了几个关键点:“36岁”、“胎儿染色体异常”、“三代试管”。这些关键点的背后,都蕴藏了哪些信息,让我们一个一个来分析。
事关卵子质量
关键点一:高龄
“高龄产妇”是大家耳熟能详的词汇,“再不生就年纪大了,影响孩子”也是许多人的担忧或劝辞。但是,目前已有文献对高龄的定义尚无共识。
在产科,高龄定义为孕妇分娩时年龄≥35岁,其生育力显著下降,胎儿发育不良、子代出生缺陷的风险显著增高。一项关于女性生育年龄对生育能力影响的报道显示,在20~24岁已婚女性中,不孕症发生率为6%,25~29岁为9%,30~34岁为15%,35~39岁为30%,40~44岁达64%。
在生殖领域,则有不同的区分方法。据统计,女性绝经年龄多在40~60岁,平均年龄为51岁。但是,卵巢衰老的速度存在个体间差异,生理年龄不等于卵巢年龄,应从卵巢储备功能*的角度来定义“高龄”,而不限于她的实际年龄。
* 卵巢储备功能的评估方法有很多,主要包括:临床指标,基础激素水平,卵巢影像学,卵巢刺激实验。
卵巢储备功能直接关乎卵子的数量。不少人都听说过,女性一生中卵子的数量是有限的,但究竟是多少呢?
女性的卵子在卵巢中要经历原始卵泡→初级卵泡→次级卵泡→成熟卵泡漫长发育过程。新生女婴两侧卵巢有70~200万个原始卵泡,7~9岁时约有30~50万个,青春期约有4万个,到绝经期时,仅剩几百个。从青春期开始,每月约有15~20个原始卵泡同时开始生长发育,但是通常只有1~2个可以发育成熟并排卵。最终,女性一生中共排卵400~500个,其余卵泡均在发育过程中退化。
然而,对于原因不明的不孕症,“高龄”可定义为≥30岁。对于存在不孕高危因素的女性,例如单卵巢、卵巢囊肿摘除术、吸烟、有家族卵巢早衰(POF)史等,“高龄”也应定义为≥30岁。
关键点二:染色体异常
染色体是遗传物质基因的载体,基因通过细胞分裂,随着染色体的传递而传递。染色体如果发生异常,如数目和结构改变,都会造成基因的增加或缺失,导致染色体病。染色体异常的胚胎,大部分流产或死产;存活下来的患者,多具有先天性多发畸形、智力发育障碍、生长发育迟缓等临床特征。
我们知道,人类生殖细胞成熟后所采用的是一种特殊的分裂方式:减数分裂。所谓减数,就是分裂后的生殖细胞染色体数量减半——DNA复制1次,细胞连续分裂2次,最终形成的子细胞,染色体数目只有母细胞的一半。
减数分裂大致分为两个阶段:减数分裂I期和减数分裂II期。女性的卵细胞(卵子)是由卵母细胞经过两次减数分裂而来,其染色体从卵母细胞的46条(以2n表示,称为二倍体)变为23条(以n表示,称为单倍体),性染色体也由XX变为单独一条X。
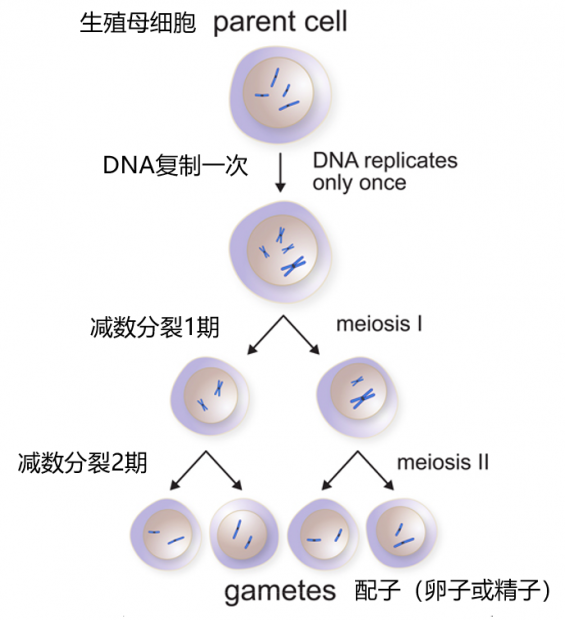
在卵泡发育的最后阶段,成熟卵泡会在排卵前36~48小时完成第一次减数分裂,产生1个次级卵母细胞。当卵泡发育为成熟卵泡后,其向卵巢表面移动,成熟卵泡壁破裂,次级卵母细胞及其他成分一起从卵巢排出,这就是排卵。
排卵后次级卵母细胞的命运分为两种,在24小时内未受精,次级卵母细胞即退化;如果与精子相遇受精,次级卵母细胞即完成第二次减数分裂,形成1个成熟的卵细胞,也就是卵子。
女性卵巢衰老会造成生育能力下降,而卵巢衰老的主要表现,不仅在于卵母细胞数量的减少,还有细胞质量下降。随之出现的是卵母细胞染色体非整倍体发生率增加。非整倍体,就是指细胞内染色体数目增加或减少了1条或数条。例如,某号染色体少了1条,就叫单体型(2n-1);某号染色体多了1条,就叫三体型(2n+1)。卵母细胞非整倍体发生的原因还不完全明确。现有研究显示[1],在女性卵细胞形成过程中的减数分裂II期,与年龄相关染色体结合力的减弱和丢失,姐妹染色单体过早的发生与纺锤体微管的偏移和错配,使染色体分离错误,是出现非整倍体的主要原因。
据统计,35岁女性卵母细胞染色体非整倍体的发生率约10%,40岁女性急剧上升至30%,43岁为40%,而45岁以上女性的卵母细胞几乎均为非整倍体。因此,随着年龄的增加,唐氏综合征(即21-三体综合征)、18-三体综合征、13-三体综合征等染色体异常的发生率、流产率也相应增加,38岁以上女性流产率可达30%~40%。
在这里,我们稍微延伸一下话题。卵母细胞非整倍体的发生是影响高龄女性生育能力的重要原因,那这种情况会不会在年轻女性中出现?
答案是“会”。
一个月前,发表在《美国人类遗传学杂志》(American Journal of Human Genetics)上的一项研究发现[2],超过7%的卵母细胞至少存在一对“无交换”染色体,且这种情况不受母体年龄的影响。如果含有无交换染色体的卵母细胞进行了减数分裂,则产生非整倍体子代的风险显著升高。
文章第一作者Terry Hassold在接受采访时表示:“根据我们的咨询经验,一些经历过流产或有过额外或缺失染色体孩子的夫妇常常有负罪感。我们的研究结果表明,事实恰恰相反,这些染色体中的许多错误是人类生物学中固有的。”
辅助生殖技术
关键点三:三代试管
三代试管,既往也叫胚胎植入前遗传学诊断(PGD)、胚胎植入前遗传学筛查(PGS),目前统称为“Preimplantation Genetic Testing”(PGT),即“植入前胚胎遗传学检测”。有人可能会问,既然叫“三代”,是不是比“一代”和“二代”更高级?并不是!第一代(体外受精-胚胎移植,IVF-ET)、第二代(卵胞质内单精子注射,ICSI)、第三代试管的名称,只是代表了三种不同的助孕技术,分别针对不同原因导致的不孕,三者之间不存在优劣。
三代试管,PGT,根据不同的指证,又可分为三类。第一类,PGT-A,A指Aneuploidies(非整倍体),适用于女方高龄、不明原因反复自然流产、不明原因反复种植失败等,即文章开始展示的病例;第二类,PGT-SR,SR指Structural Rearrangements(结构重排),适用于夫妇任何一方或双方携带染色体结构异常,包括易位、倒位等;第三类,PGT-M,M指Monogenic defects(单基因病),适用于携带有严重疾病的遗传易感基因的致病突变患者,以及需要人类白细胞抗原(HLA)配型的情况。PGT通过对胚胎染色体进行筛查,将异常胚胎剔除,从而减少流产和生育异常后代的风险。
PGT是复杂的医学与现代生物技术相结合的工程。操作过程包括:
1、激素诱导超排卵,获得卵母细胞;
2、用常规体外受精或卵母细胞胞质内单精子注射,体外培养;
3、取部分胚胎细胞通过分子生物学方法进行相应的检测;
4、将经分析正常的胚胎移植入子宫。
1968年,英国剑桥大学生理学家R.L.Gardner和R.G.Edwards首次将PGT技术应用于兔子,他们通过性染色质鉴别胚胎的性别,后实验确定为雌性胚胎,将胚胎放入受体雌兔的子宫中,最后成功诞生了一批雌性小兔[3]。1990年,世界上首例应用于人类胚胎的PGT,由英国伦敦皇家医学研究生院哈默史密斯医院妇产科A.H.Handyside团队完成,治疗对象为携带X连锁隐形遗传病的夫妇。研究人员利用单细胞聚合酶链式反应(PCR)对植入前胚胎进行性别鉴定,挑选女性胚胎进行移植,最终成功分娩健康双胎女婴[4]。2000年5月,我国中山大学附属第一医院生殖中心成功对血友病携带者进行PGT,诞生国内首例经PGT技术出生的健康婴儿[5]。时隔20年,羊城晚报微信采访了当年“勇于吃螃蟹”的母亲。据了解,这个女孩的成长过程很顺利,和其他孩子没有区别,不太爱运动但是记忆力很不错,正在读大学[6]。
1990年首个接受PGT治疗的病例,当时使用的分子生物学技术是PCR。随着科学技术的不断发展,更多细胞遗传学技术被应用在PGT中,极大地提高了PGT的准确率和效率,例如荧光原位杂交技术(FISH)、全基因组SNP微阵列芯片(SNP array)、二代测序技术(NGS)等。
需要特别说明的是,尽管PGT的发展很快,却也不是“万无一失”。一方面,目前人类已知有2万多种遗传疾病,染色体数目和结构的异常也是千差万别,现有的技术只能解决其中一小部分问题;另一方面,胚胎完成检测后,继续发育的过程中,受到环境、药物等因素的影响,也可能会再次发生遗传物质的改变。正如上面病例中所提到的,接受PGT治疗的患者,在孕中期需要再次进行羊水穿刺或者绒毛膜活检来确定胚胎的遗传状况。以上海交通大学医学院附属仁济医院生殖中心的数据为例,PGT移植周期成功率在60%~70%。
病例中的关键点基本讲完了,看到这里,或许有人会发出这样的感叹:好像PGT也不过如此!对于那些又想专注于事业,又想保存生育能力的女性,是否还有更好的解决方法?近些年,西方国家单身女性冻卵已经进入公众的视野,女明星的“亲身示范”,更把冻卵捧成了保存生育的“后悔药”。2019年12月,一名31岁未婚女子向北京朝阳区法院起诉北京妇产医院生殖中心拒绝为其冷冻卵子的案例,更把冻卵推上了风口浪尖[7]。
冻卵:不够保险的保险箱
所谓冻卵,顾名思义就是“把卵细胞冷冻起来”。目前,应用于卵母细胞冷冻的方法主要有慢速程序化冷冻和玻璃化冷冻。慢速程序化冷冻是早期使用的方法,卵母细胞在低浓度保护剂的保护中,在程序化冷冻仪控制下,缓慢地程序性降温,最后置于液氮中保存。随着冷冻方法的不断改进,程序化冷冻逐渐被玻璃化冷冻所替代。后者是利用高浓度冷冻保护剂,将卵母细胞迅速降温,使得胞内液体直接转化为一种非晶体的玻璃样状态,最后置于液氮中保存,减少了卵母细胞内部结构的损伤,提高了成功率。
相较精子冷冻(注:精子冷冻早在1953年即开始成功应用于人工受精)和胚胎冷冻,卵母细胞冻存技术的发展较缓慢。1986年,澳大利亚科学家首次报告用冷冻卵子(注:当时使用的是慢速程序化冷冻)结合试管婴儿技术获得成功妊娠[8];2004年,我国首个“冷冻”(注:使用的是慢速程序化冷冻)宝宝在北京大学第一医院出生[9];2013年,美国生殖医学协会(ASRM)正式摘掉冻卵的“实验性”标签[10],可以广泛应用于临床,被视为“赋予女性生育权利的时代到来”。冻卵的具体技术、社会、伦理等问题,这里不做讨论,让我们来重点关注一下冻卵的遗传学问题。
从遗传学角度,既往认为,冻卵是安全的。然而,随着相关研究的不断增加,这个结论需要重新考虑。2019年,《美国医学会杂志》(JAMA)发表了一项回顾性队列研究[11],由丹麦癌症协会研究中心牵头完成,分析1996年~2012年间,当地出生的1,085,172名婴儿的生长发育情况。结果显示,使用冷冻卵子出生的婴儿,儿童期的患癌风险为44.4/10万,自然受孕出生的婴儿,风险为17.5/10万。也就是说,前者的患癌风险是后者的两倍多。其中,白血病和交感神经系统肿瘤的风险升高较明显。而其他辅助生殖技术,例如体外受精、卵胞质内单精子注射等,并未发现相关联系。作者在讨论部分中指出,低温保存技术可能会引起胚胎发育变化,潜在影响其在子宫内的生长,表观遗传学改变是一种可能的解释。
“龙生龙,凤生凤”是我们对“遗传”最直观的理解。但是,“龙生九子,各有不同”的现象,也暗示着遗传的过程中,除了基因,还有其他的生物学机制发挥了作用。表观遗传,指的就是DNA序列不改变的情况下,基因表达中的多种变化,例如DNA修饰、翻译后修饰等,这种变化可以稳定遗传。而低温保存技术可能会引发胚胎的表观遗传改变,给婴儿将来的成长带来风险。
围绕卵母细胞玻璃化冷冻对表观遗传和基因表达的影响,2020年8月,《临床表观遗传学》杂志(Clin Epigenetics)发布一篇综述[12]。分析显示,表观遗传调节方面,动物研究中发现,冻卵对DNA甲基化、miRNA、组蛋白修饰均有影响;基因表达方面,人群研究中发现,冻卵可能会降低卵母细胞发育相关的转录水平,动物研究中则显示出转录调控、细胞分化和有丝分裂、肌动蛋白细胞骨架调控以及凋亡途径的改变。由此可见,由于冻卵技术的历史只有30多年,冻卵的遗传学安全性问题,需要未来更多的研究来完善,冻卵并不是“生育保险箱”。
总 结
传统观念中,注重“在合适的年龄,做合适的事情”。但是随着社会节奏的加快,很多女性及其家庭不得不面对“高龄”这个问题,并求助于现代医学。影响女性生育能力的因素有很多,今天所说的只是其中一部分。
加拿大皇家学院(科学院)院士Peter Leung教授给《实用人类辅助生殖技术》(黄荷凤编,人民卫生出版社2018版)作序时写道:“医学知识和技术的进步,给人类的生命和健康带来了令人欣喜的成就,辅助生殖技术日新月异,开创孕育生命的新篇。”但是,从医生的角度,我们也希望能充分告知大家医学的“不完美性”。保持客观理性,大自然会给我们优胜劣汰最好的结局。
参考文献
[1] Maria Shomper, Christina Lappa, and Greg FitzHarris. Kinetochore microtubule establishment is defective in oocytes from aged mice. Cell Cycle. 2014;13(7):1171-9.
[2] Terry Hassold, Heather Maylor-Hagen, Anna Wood, et al. Failure to recombine is a common feature of human oogenesis. Am J Hum Genet. 2021;108(1):16-24.
[3] R.L.Gardner, R.G.Edwards. Control of the sex ratio at full term in the rabbit by transferring sexed blastocysts. Nature. 1968;218(5139):346-9.
[4] A.H.Handyside, E.H. Kontogianni,K. Hardy, et al. Pregnancies from biopsied human preimplantation embryos sexed by Y-specific DNA amplification. Nature. 1990;344(6268):768-70.
[5] 徐艳文,庄广伦,舒益民,等. 应用荧光原位杂交技术进行胚胎植入前性别诊断. 中华医学杂志(英文版). 2002;115(6):874-877.
[6] 羊城晚报. 2020.07.14. 中国首个第三代试管婴儿今年20岁了,就出生在广州!
[7] 北京日报客户端. 2019.12.23.“冷冻卵子”遭医院拒绝,女子告上法院.
[8] C Chen. Pregnancy after human oocyte cryopreservation. Lancet. 1986;1(8486):884-6.
[9] 李晓红. 人卵母细胞冻融的研究与应用. 北京大学学报(医学版). 2004;36(6):664-667.
[10] Practice Committees of American Society for Reproductive Medicine, Society for Assisted Reproductive Technology. Mature oocyte cryopreservation: a guideline. Fertil Steril, 2013;99(1):37-43.
[11] Marie Hargreave, Allan Jensen, Merete Kjær Hansen, et al. Association Between Fertility Treatment and Cancer Risk in Children. JAMA. 2019;322(22):2203-2210.
[12] Julie Barberet, Fatima Barry, Cecile Choux, et al. What impact does oocyte vitrification have on epigenetics and gene expression? Clin Epigenetics. 2020;12(1):121.
话题:
0
推荐
财新博客版权声明:财新博客所发布文章及图片之版权属博主本人及/或相关权利人所有,未经博主及/或相关权利人单独授权,任何网站、平面媒体不得予以转载。财新网对相关媒体的网站信息内容转载授权并不包括财新博客的文章及图片。博客文章均为作者个人观点,不代表财新网的立场和观点。




 京公网安备 11010502034662号
京公网安备 11010502034662号 