阅读:0
听报道
网上热议能不能、该不该吃胎盘的时候,有人说胎盘是一坨“脏乎乎的”“恶心”的“医疗垃圾”。其实,作为我们来到人间的第一站,胎盘的发育决定着胎儿的生长。要解开胎盘发育的谜团,第一步,就是在体外培养一个胎盘。
撰文 | 李卓思(上海理工大学医食学院)
胎盘是哺乳动物的新生命在这个世界上的第一个落脚之处(图1)。它伴随着胎儿的降生、成长,直到这个新生的幼崽离开母腹,亲自吸入第一口空气,胎盘便被排出母体,完成了自己的使命。可想而知,作为一个仅存在于母腹中的临时性器官,人们要观察它、研究它是非常困难的。
但是,胎盘的生长直接关系到胎儿的发育。许多孕早期胎停的病例,就与胎盘发育不良有关。科学家们希望在体外模拟胎盘的生理过程,在他们的不懈努力之下,现在,我们已经能高效培育人工胎盘细胞,并让它们“怀孕”了。
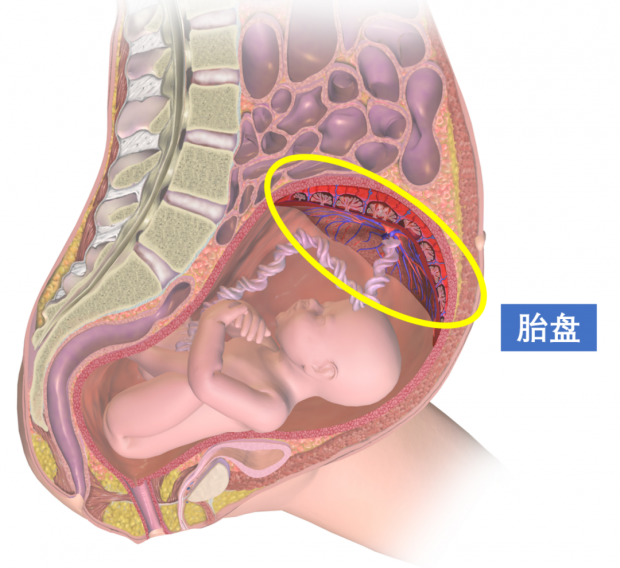
图1. 人类子宫中的胎盘丨来源:维基百科
胎盘——新生命的第一道守护
胎盘来源于胎儿,而非母体,它是哺乳动物为了生存发育而形成的一种临时性器官,起着连接母体、摄取营养、保护自己的作用,担负着母亲与胎儿之间物质交流的重要使命。
作为母体和胎儿之间物质的“过路卫士”,胎盘帮助胎儿从母亲的血液中获取营养和氧气,并移走子宫中的废物。同时,胎盘还可以合成多种酶、细胞成长因子和激素,促进胎儿在子宫中的发育。
此外,胎盘的结构十分复杂,可以有效屏蔽病原体和毒素等来自外界的侵害,是保护胎儿的第一道屏障。而来自母体的免疫球蛋白IgG则是唯一可以通过胎盘的免疫球蛋白——它能保护出生后完全没有抵抗力的婴儿,发挥着活体防御的功能。
如果胎盘功能不正常,妈妈和胎儿的健康都会受到影响,甚至威胁到生命安全。因此,研究这种临时器官就显得尤为必要。
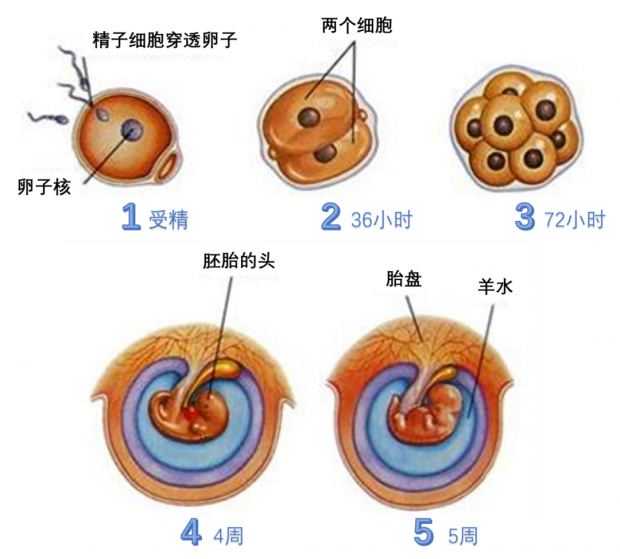
图2.受精卵形成并分化为胚胎和胎盘的过程。丨来源
五个阶段:1,受精时,精细胞的核与卵细胞的核融合成为受精卵;2,受精后大约36小时卵子便开始一次分裂,成为两个细胞;3,受精后大约72小时便变成16个细胞,几天之后细胞团就清理到子宫内;4,4周后,胚胎浸泡在充满液体的囊中,心脏开始挑动,大脑开始发育;5,5周后,胚胎大约有苹果核大,开始出现将会变成上肢和下肢的胚芽,局部开始萎缩。
人体胎盘的构成——人类生命诞生的神奇之处
胎盘为什么会有这么奇妙的屏障功能?科学家认为,这一定与构成它的细胞有关。随着分子生物学的进步,人们对胎盘细胞群的构成和由来有了进一步的认识——胎盘细胞群并不只是由一种细胞构成的,而是可以分为三类:胎盘干细胞、胎盘合胞体滋养层细胞、绒毛外滋养层细胞。
卵子和精子结合形成受精卵之后,受精卵就开始快速分裂增殖,当形成32个左右的细胞团时,我们称其为桑椹胚;桑椹胚进一步发育,细胞开始分化,形成囊胚,一些个体较大的细胞,聚集在囊胚一侧,称为内细胞团,将来发育成胎儿的各种组织。而另一些个体较小的细胞,沿透明带内壁扩展和排列的,称为滋养层细胞,它们将来发育成胚膜和胎盘。这时的滋养层细胞也被称之为胎盘干细胞。
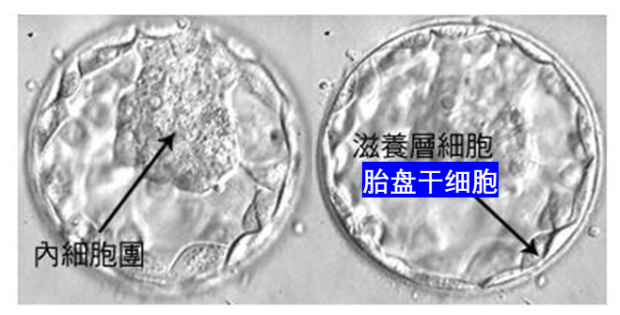
图3. 来源
随着囊胚的继续发育,内部细胞团经过分化生成身体的各个器官,如心脏、肝脏、骨骼和脂肪等等;同时外部的胎盘干细胞也分化发育成胎盘。所谓分化,就是指同一来源的细胞逐渐产生出形态结构、功能特征各不相同的细胞类群的过程。
胚胎发育至13~21日时,胎盘的主要结构——绒毛——逐渐形成(图4)。绒毛的最外层覆盖着胎盘合胞体滋养层细胞。每一个大的合胞体滋养层细胞都由多个胎盘干细胞融合而成,含有多个细胞核,这类细胞的形成,有效地减少了细胞与细胞之间的通道,可以最大程度阻挡有害物质进入胎儿体内,因此合胞体滋养层细胞在胎盘中是起屏障作用的细胞层。
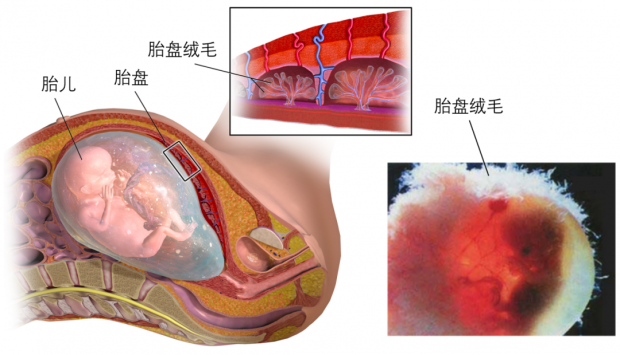
图4. 胎盘和膜上的绒毛。绒毛是胎盘的主要结构。丨来源:维基百科。左图By BruceBlaus - Own work, CC BY-SA 4.0,
此后,绒毛持续发育,绒毛内形成血管形成,建立起胎儿-胎盘循环。与此同时,绒毛内部的胎盘干细胞,分化成形状不规则、有小刺突的绒毛外滋养层细胞,它们能帮助胎盘绒毛着床并定植在母体的子宫内膜上。这种细胞具有非常强的侵入性,它可以从胎盘绒毛的尖端浸润至母体的子宫内膜,再进一步侵入子宫内膜螺旋动脉,使母体的动脉由收缩状态转变为舒张状态,以此使母体的血液更快更多地供给胎盘,帮助胎儿成长。这种作用在胎儿的生长后期尤为明显。
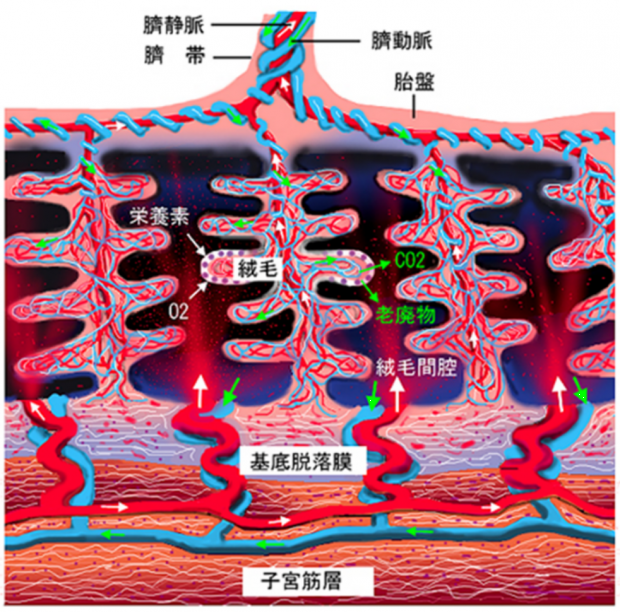
图5.绒毛内的物质循环示意图丨来源:维基百科
合胞体滋养层细胞与绒毛外滋养层细胞,二者都是在胎盘形成的过程中由胎盘干细胞而来,二者相辅相成,具有不同的功能,共同构成了胎盘中重要的部分。我们可以这样理解:合胞体滋养层细胞的形成是为了尽可能保护胎儿,而绒毛外滋养层细胞的作用则是为了胎儿能更好地从母体获得营养。人类生命诞生的神奇之处在这两种细胞的分化之中尽显无疑。
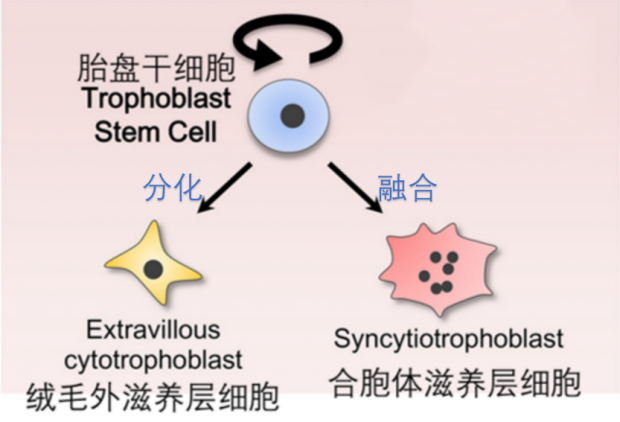
图6. 囊胚中的胚胎干细胞(蓝色)分化为两种细胞:多个干细胞融合成合胞体滋养层干细胞(红色),分布于绒毛表面,起屏障作用;随后分化为侵入性很强的绒毛外滋养层细胞(黄色),帮助胎盘着床、从母体吸取营养。[1]
怎样获取有活性的胎盘细胞?
胎盘仅存在于母体妊娠期间,直接研究人体胎盘,不仅难度大、耗时长,而且很可能威胁到胎儿的健康。因此,以往研究胎盘物质运输、胎盘药物透过性、胎盘发育等课题,主要依赖于动物模型和实验室生长的人类胎盘细胞。
虽然这些方法已经为我们提供了许多有用的信息,但是想要模拟真实的人类胎盘的发育过程,依然困难重重。如何有效而且快捷地在体外进行与胎盘相关的研究,一直是生物学界长期存在的难点。
为了更广泛、更深入地研究胎盘的发育和功能,目前科学家们主要通过以下三种途径获得能在培养皿中培养的人类胎盘细胞。
第一种途径,是从母体获得成熟的或未成熟的胎盘,再从这些胎盘的组织中分离初代胎盘细胞,学术上称之为“滋养层细胞”,也就是构成胎盘绒毛的细胞群。但是,这些从母体组织上分离得到的胎盘细胞,只能在体外短暂培养,而且不能分裂繁殖传代,所以无法用于复杂的实验。
直到2019年,日本东北大学的研究者们才找到了合适的培养基,使此类细胞的长期体外培养成为可能。但胎盘组织来源有限,且受限于相应的伦理问题,从母体胎盘组织获得细胞的方法注定无法得到广泛的推广。

图7.刚完成分娩的雌性海狮与其幼崽(地上的胎盘清晰可见),作者:Tony Andrews丨来源:
第二种途径是使用恶性程度很高的绒毛膜癌细胞。由于这种细胞来自于孕卵的滋养层成分,所以和正常的胎盘细胞具有十分相似的性质。同时,又因为这种细胞亦属于癌细胞,因此增长快,对培养基的要求不高,是非常容易使用的一种体外细胞。
但是,癌细胞具有恶性转移的性质,所以很难用它来完全模拟体内胎盘的活性。
第三种途径是用诱导性多能干细胞(Induced pluripotent stem cell,常称为iPS细胞)来制作胎盘细胞。从皮肤、血液、尿液、脂肪中提取出体细胞,导入多能性诱导因子培养制成的细胞就是iPS细胞,它能够分化成人体各种组织脏器,并无限增殖。
由于iPS细胞来源于体细胞,不涉及与人体胚胎组织有关的伦理问题,医生可以提取患者自身的体细胞来培殖胎盘细胞,来治疗患者。因此这种途径应用更广泛。
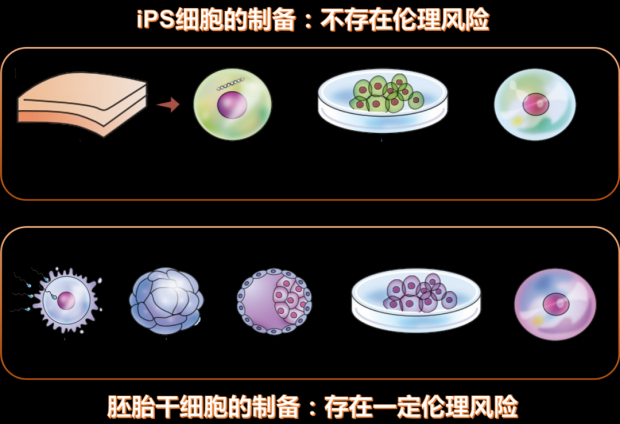
图8.iPS细胞和胚胎干细胞的对比丨作者制图
培育胎盘干细胞——从20天到3天
为了分别获得具有活性和功能的胎盘干细胞、合胞体滋养层细胞和绒毛外滋养层细胞,科学家绞尽了脑汁。由于合胞体滋养层细胞和绒毛外滋养层细胞都是由胎盘干细胞分化而来,所以总体的研究思路是,首先必须获得一种能模拟体内细胞性质的胎盘干细胞,其次再验证所获的胎盘干细胞是否能在培养皿中融合成合胞体滋养层,并分化成侵入性的绒毛外滋养层细胞。
2019年,日本理化学研究所的岩田教授团队运用物理手段获得了胎盘干细胞后,在只有5微米厚的镍网上面培养诱导多能干细胞(iPS细胞),20天后,细胞层上方长出了很多小囊泡。用验孕试纸测定长有小囊泡的培养液时,发现试纸呈阳性——也就是“怀上了”!所以可以初步认定,这些囊泡中含有胎盘性质的细胞。
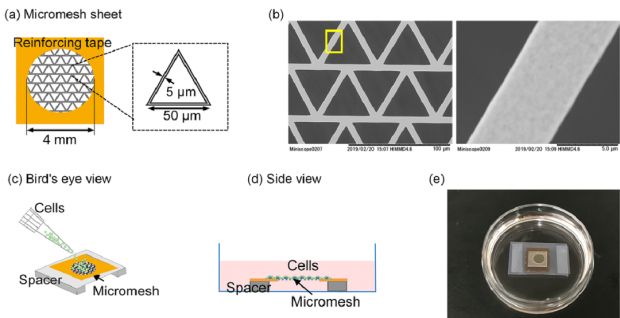
图9.在5微米厚的镍网上培养多功能干细胞[2]
研究人员将这些小囊泡用剪刀小心取下,再放入适合胎盘细胞生长的培养基中。经过若干代的纯化培养,便获得了胎盘干细胞。它们能够不断增殖,并且能在体外分化成合胞体滋养层细胞和绒毛外滋养层细胞。可以说,这是人类第一次使用诱导多能干细胞获得了真正意义上“具有功能”的胎盘干细胞。
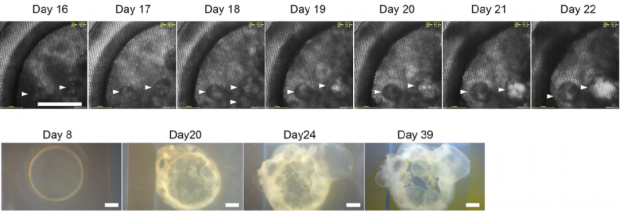
图10. 在5微米厚的镍网上培养多功能干细胞,经过20天左右,上方长出了小囊泡[2-3]
岩田团队的成果虽然鼓舞人心,但缺陷也是显而易见的:耗时太长。这一方法需要的周期长达二十多天,并且从获取的囊泡中提取单一的胎盘干细胞时还需要额外的时间。
今年4月,日本京都大学高岛团队在《细胞·干细胞》(Cell Stem Cell)上发表了他们的研究成果,把体外培育胚胎干细胞的周期缩短到了3天[5]。他们是怎么做到的?
秘密就在于高岛团队使用了不同的干细胞来源。
岩田团队在培育胎盘干细胞时,采用的是成熟干细胞;而高岛团队则利用了原初干细胞作为培养来源。他们用原初干细胞建立了一个体外的分化系,由原初干细胞分化得到原初滋养外胚层,再到原初胎盘干细胞,而原初胎盘干细胞能经过药物诱导融合成合胞体滋养层,并分化成绒毛外滋养层细胞。
这两种干细胞有哪些不同呢?虽然原初干细胞和成熟干细胞都具有多功能分化的性质,但二者实际上处于受精卵发育的不同阶段。原初干细胞可以被认为是由受精卵形成的囊胚体的内部细胞,而成熟干细胞更接近于囊胚着床后的上皮细胞,因此原初干细胞更原始。
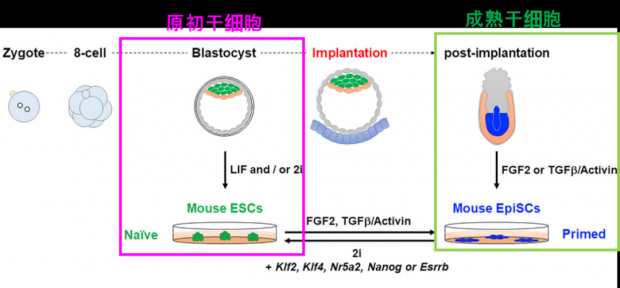
图11.原初干细胞和成熟干细胞的区别[4]
同时,相比于成熟的干细胞,使用原初干细胞分化得到的胎盘干细胞,非常接近人体胎盘细胞的性质。而且从原初干细胞到胎盘细胞,只需要三或四种有效药物刺激、诱导三天,就可以完成,分化方法更易操作,这也极大降低了其他研究者获得所需要胎盘细胞的难度。
利用干细胞获得构成胎盘的三种细胞,是人类生物发育学研究的重要进步之一。这些研究成果的出现,让我们能够更好地了解胎盘的发育过程和与胎盘相关的疾病。
参考文献
[1] Okae H, Toh H, Sato T, Hiura H, Takahashi S, Shirane K, et al. Derivation of human trophoblast stem cells. Cell Stem Cell 2018, 22(1): 50-63 e56.
[2] Li Z, Kurosawa O, Iwata H. Establishment of human trophoblast stem cells from human induced pluripotent stem cell-derived cystic cells under micromesh culture. Stem Cell Research & Therapy 2019, 10(1): 245.
[3] Li Z, Kurosawa O, Iwata H. A comparative study of key physiological stem cell parameters between three human trophoblast cell lines. Biochemical and Biophysical Research Communications 2020.
[4] Semi K, Takashima Y. Pluripotent stem cells for the study of early human embryology. Development, Growth & Differentiation 2021.
[5] Io S, Kabata M, Iemura Y, Semi K, Morone N, Minagawa A, et al. Capturing human trophoblast development with naive pluripotent stem cells in vitro. Cell Stem Cell 2021.
话题:
0
推荐
财新博客版权声明:财新博客所发布文章及图片之版权属博主本人及/或相关权利人所有,未经博主及/或相关权利人单独授权,任何网站、平面媒体不得予以转载。财新网对相关媒体的网站信息内容转载授权并不包括财新博客的文章及图片。博客文章均为作者个人观点,不代表财新网的立场和观点。




 京公网安备 11010502034662号
京公网安备 11010502034662号 