阅读:0
听报道
读完今天的文章,你将搞清以下问题:
1. 病毒是怎么变异的?
2. 病毒改变多少,才算是新毒株?
3. Delta株传染性增强,为什么毒力没有降低?
4. 人类能消灭新冠病毒吗?
但是,在此之前,我们要先谈一谈什么是“种”。
撰文 | 李庆超(山东师范大学)
新冠病毒一直在变异。疫情反反复复,人人提心吊胆。我们期盼着特效药能击败它、物理隔离能阻止它、疫苗能消灭它,结果它又来了,换了马甲又来了。这一次来势汹汹的Delta毒株,去年10月就在印度出现了,它究竟是怎么产生的?是怎么鉴别出来的?它这么厉害,还会有更厉害的下一代吗?它的传染性增强了,还会进化出新病毒吗?……
在回答这些问题之前,我们要先谈一谈“种”的问题。
先有鸡?先有蛋?
先有蛋还是先有鸡?先贤亚里士多德给不出答案,生物学家却能给出确切的答案。
因为面对这个问题的时候,他们脑海中的“鸡”和“蛋”的概念是不同的。亚里士多德思考的是“鸡生蛋,蛋生鸡”,这种互为因果的无限序列是没有真正起源的[1]。而生物学家会先问清楚,这里的“蛋”是什么蛋,“蛋”的定义是什么,之后可以给出比较合理的解释。如果“蛋”指的是鸡蛋、鸭蛋这类鸟蛋,甚至加上乌龟蛋、恐龙蛋爬行动物的蛋这类,这类羊膜卵大概出现在3.12亿年前[2]。而鸡(Gallus gallus domesticus),是由红原鸡 (Gallus gallus)驯化而来,最多可能是八千年前[3]。如此说来,蛋的出现远远早于鸡。
明确一下,如果“蛋”就是指“鸡蛋”呢?一般认为,鸡蛋是“鸡下的蛋”,即便这个蛋落地能打滚,劈开蹦出个哪吒来,也没关系。相比而言,“能孵出鸡”,并不是成为鸡蛋的必要条件。这么一来,鸡蛋就必须有个叫鸡的动物去生它,于是逻辑上讲,显然是先有鸡。
那么这只开天辟地的鸡从哪里来呢?从蛋里孵出来的,而这个蛋是一个与鸡很接近,但还不是鸡的动物下的。因为鸡的概念中,“从鸡蛋里孵出来”虽然是一个事实,但是万一可以从别的蛋里孵出来,不妨碍它是一只鸡。
如果强调这个鸡蛋是“能孵出鸡”的蛋呢?那答案就是先有蛋。因为在这种认识下,实质上是把鸡的整个生命过程延伸到了受精卵阶段。人们对多种野生丛林家禽的杂交和驯化产生鸡的过程知之甚少,因此无法确切知道鸡的非鸡祖先与鸡之间是否存在一个清晰的转换点。与现代鸡几乎相同的动物(即原始鸡)产下的受精卵具有与现代鸡相同的 DNA(因为母亲的卵子、父亲的精子或受精的受精卵发生突变),那么这个蛋就已经是(能孵出鸡的)鸡蛋了。因此从这个角度讲,先有蛋。只不过这个蛋可能是“不是鸡的动物”产的。
Ok,如果这个鸡蛋是“鸡生的蛋”,并且“能孵出鸡”呢?好吧,这样的话,这个题目真正回归它的本意了:循环论证,无始无终。
“种”之“辨”:物种的概念
从上面的讨论我们看出,明确概念并达成共识是进行有效讨论的前提。
概念有时候是模糊的。概念的模糊性有时候还真不是因为咱读书少,而是因为概念本身就是个人造的物件儿,而它所描述的事实却丰富多彩得多。用一句“违背祖师爷遗训”的话来说:概念是人们用来描述现实的,而现实并不负责“长在”概念上。尤其是生命科学,“祖师爷”留下的概念可是老被突破和扩充。
比如“种”这个概念,就极其复杂(看到“种”这个汉字,你脑袋里会涌现一系列认识)。单就“物种”(species)一词也够来一壶了(生殖隔离吗?只有这个那就格局小了)。科学哲学家约翰·威尔金斯 (John Wilkins) 细数了 26种“物种”的概念,并进一步将物种概念分为七种基本概念[4]:
(1) 基于生殖隔离的有性生物的biospecies(生物物种)
(2) 基于无性生殖(克隆群体)的agamospecies (无性种)
(3) 基于生态位的生态物种
(4) 基于进化谱系的进化物种
(5) 基于遗传隔离的遗传物种
(6) 基于表型差异的形态物种
(7) 分类物种,即由分类学家确定的物种。
我们回到鸡生蛋的问题上来,鸡这个物种是由红原鸡演化而来,红原鸡在繁衍过程中不断出现突变,并被筛选,最终形成了我们今天所熟知的鸡。可是红原鸡从哪一“辈”开始,或者从哪一个蛋开始就孵出了真正意义上的鸡了呢?这个答案难以考证,或许也无法回答。人为规定的、虚拟的经纬线是精确的固定的,天然形成的、实实在在的海岸线却难以测量出真正的长度。概念很美好,但真正使用一个个概念去考察一个连续变动的现实过程时,就会感觉很费劲。因为物种的演化过程是渐进和连续的,突变需要一步一步地变。
“种”之“变”:突变与变种
给新冠病毒起名字,主要考虑的是病毒之间的演化关系。
2020年2月11日,国际病毒分类委员会ICTV宣布将新型冠状病毒正式命名为“严重急性呼吸综合征冠状病毒2”(severe acute respiratory syndrome coronavirus 2),英文简写为SARS-CoV-2)[5]。这表明,新型冠状病毒从分类学角度上讲,是SARS冠状病毒(SARS-CoV)的近亲。
ICTV强调,新型冠状病毒(SARS-CoV-2)名称中的 SARS 是为了突出它们与原始病毒在演化上的关系,而不是临床疾病层面的关系。这一命名是分类学家给出的命名,但是蕴含了表型(可导致肺炎)、形态及分类地位(病毒颗粒皇冠状的冠状病毒科)及近缘关系(跟SARS病毒比较接近)等丰富的信息。这个名字比较清晰地界定了造成本次疫情的病毒物种。
突变
没有突变就没有多彩多姿的生命,更不会有人类。这种潜存于每次细胞增殖、个体繁殖和病毒复制过程中的遗传物质复制的“错误”,给自然选择创造了差异化的“选手”,是演化得以进行的原材料。
遗传信息储存在核酸的一级结构中,就像这篇文章,也是由字符组成的,只不过核酸的“字符”是碱基。遗传物质的传递就是碱基序列的复制。这个过程是复制酶完成的。
Tips:聚合酶Vs复制酶
生命中遗传信息的传递需要将核苷酸(底物)按照母本序列(模板)、以碱基互补配对的方式,合成新的子代核酸(产物),这个反应是由聚合酶(Polymerase)催化的。
不同的聚合酶可以将遗传信息传递给新基因组,发挥复制的功能,称为复制酶(Replicase);或者将遗传信息传递给非基因组的功能性RNA分子(mRNA等),发挥转录功能。
根据模板、子代核酸的种类不同来分,聚合酶可以分为(以DNA为模板,合成DNA的)DNA聚合酶、(以DNA为模板,合成RNA的)RNA聚合酶、(以RNA为模板,合成RNA的)RNA复制酶、(以RNA为模板,合成DNA的)逆转录酶等。
广义的突变(Mutation)是指遗传信息(核酸序列)的改变。病毒是一种无细胞结构的专性胞内寄生微生物,其核心组分是基因组核酸。将病毒基因组比喻为一本书,负责基因组扩增的复制酶相当于抄写员。从病毒整个基因组上来说,病毒突变种类有:
1. 点突变(point mutation),是指单碱基改变,或小片段的插入或缺失。点突变类似于在抄写过程中,抄写员走神,抄错了字符,它是由病毒基因组复制酶的错误复制导致的,是所有病毒基因组复制中都可能出现的一种变异形式(所有病毒生命周期中都存在基因组复制过程,而其复制酶均有不同程度的易错性),它的发生频率主要取决于“抄写员”病毒基因组复制酶的保真性,对于RNA病毒来说,其RNA复制酶不具备校对活性——也就是没法校对复制是否正确,并及时修正——因此RNA病毒的突变率是最高的。相比之下,DNA病毒(比如天花)的复制酶具有校对活性,因此突变率较低。
2. 重组(recombination),即同一种病毒不同病毒株间基因组分子的大片段交换。重组相当于抄写员抄写过程中写到一半换了一本书,新书的上半部分是《西游记》,下半部分是《红楼梦》。当同一细胞感染了两种(或以上)亲缘关系相近的病毒,基因组分子间就可能发生重组交换或基因组复制模板转移,导致重组突变。
3. 重排(reassortment),即分节段基因组病毒的基因组分子重新组合。重排类似于将1~4册《哈利波特》与5~7册《纳尼亚传奇》装在一起。重排是一种特殊的重组形式,存在于流感病毒等分节段基因组病毒中。同一细胞里面感染了两种(或以上)亲缘关系相近的病毒,病毒包装过程中分节段基因组重新分配,产生新的病毒子代。
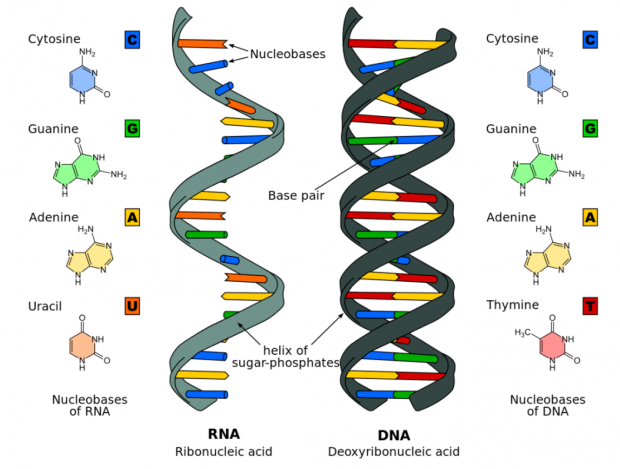
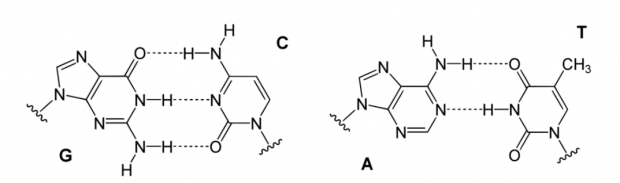
图1. RNA、DNA结构及其碱基种类。正常情况下,核酸中碱基按照A=T、C≡G的方式进行配对,在RNA中U为A=U和C≡G,图中虚线代表氢键。来源 | wikipedia
事实上用“抄写员”来比喻复制酶还不够精确,它更像一个排积木的小手,根据模板链(或称母链)的碱基排布序列,以碱基互补配对的原则,选择合适的碱基,排列出新生链(子链)。模板链1和新生链2是互补配对的关系,当新生链3按此过程产生自己的子链3时,3的序列与原模板链1完全一致。؏؏ᖗ乛◡乛ᖘ؏؏完美。
并不!
不论是DNA复制酶还是RNA复制酶,其复制过程中掺入的核苷酸并非次次准确。也就是那排积木的小手总是要放些错的积木上去……如果这些错误的碱基掺入被留在了新生链中,就是碱基突变。
突变过多会让基因组信息不稳定,影响基因组的功能。因此,DNA聚合酶往往具有校对活性(proofreading),这是一种3’到5’的核酸外切酶活性,可以将错误的碱基切掉,再继续连接正确的碱基。DNA聚合酶的保真性可以达到每复制107 到109 个碱基才发生一次错误,相当于100万字的小说抄100遍才出现一次错误(《红楼梦》约79万字)。
相比之下,RNA聚合酶没有校对活性,复制每千到每十万个碱基就可能发生一次错误,这种犯错倾向(error-prone)是RNA病毒复制酶的特性(老天爷故意的)。此外,RNA病毒基因组在患者体内的含量很大,RNA病毒复制周期短、复制水平高,每天会产生大量含有不同突变的RNA病毒基因组。这一切造就了RNA病毒极高的遗传多样性和可变性。更不用提环境诱变因素(射线、能修饰碱基的化学物质、特殊碱基或碱基类似物等)、宿主RNA编辑酶(腺苷脱氨酶等)等因素会进一步增加RNA病毒的突变率。
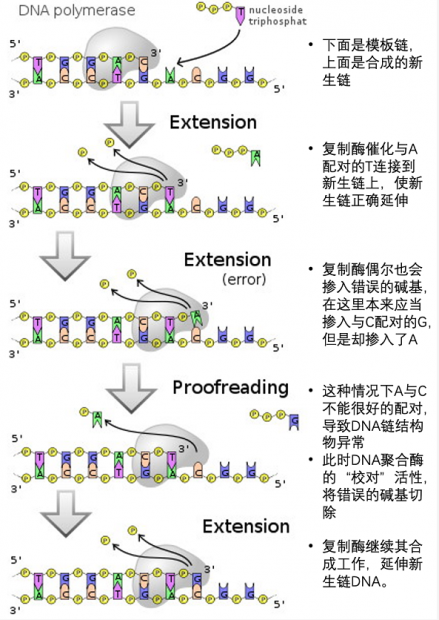
图2. DNA聚合酶催化DNA新生链延伸,并具有校对活性。[6]
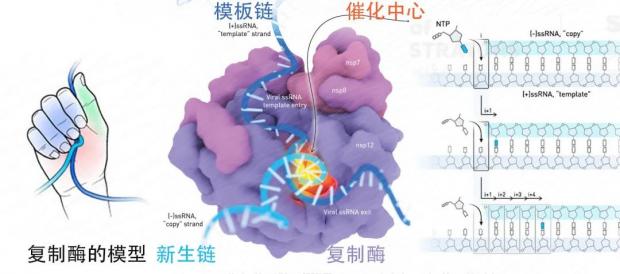
图3. 新冠病毒的复制酶。改编自Cognition Studio, Inc插画[7]
需要指出的是,对于点突变来说,由于它是病毒基因组复制酶的错误复制导致的,这种错误是随机发生的,因此病毒的突变可以发生在任何位点上。
那么,我们在检测病毒序列的时候,是否可以看到突变在整个基因组中随机分布呢?这要看突变位于何处,突变之后造成何种后果。
一般情况下,病毒的非编码序列区(不表达蛋白的地方)会有很多基于序列的重要元件,而编码序列区主要通过编码蛋白后的蛋白质功能发挥作用(三个核苷酸特定排序的密码子决定一个氨基酸)。根据突变对编码序列的影响,可以将点突变分为移码突变和置换突变。
移码突变中,由于编码序列在插入或缺失(非三整倍数)碱基后,造成读码框移码,原有蛋白质编码序列被破坏,蛋白质不能正常表达。这种情况类似于一个五言绝句古诗,插入或删除掉几个字后,你再按照五字一句来读,就不知所云了。
置换突变是指不影响读码框的点突变,其突变的后果取决于密码子发生了何种变化。
同义突变:有些氨基酸的密码子有多种,编码同一种氨基酸的密码子之间的变化不影响氨基酸种类。
错义突变:密码子的变化导致其编码的氨基酸种类发生变化。
无义突变:氨基酸密码子变为终止密码子,终止密码子可导致蛋白质合成提前终止。
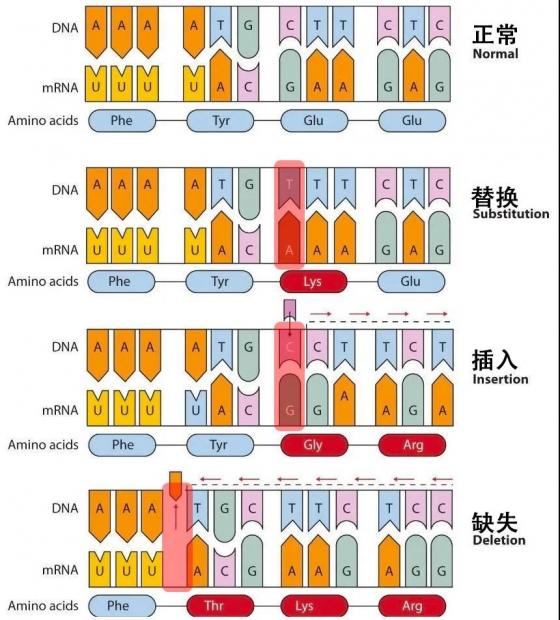
图4. 碱基配对与点突变
突变造成的后果反映到表型来说,可能有以下几种情况。
功能丧失突变(loss of function),也称为失活突变,导致基因产物功能较少或没有功能(部分或全部失活)。
功能获得性突变(gain of function),也称为激活突变,改变基因产物,使其作用变得更强(增强激活),甚至获得异常功能。使病原体的毒性增强或感染新宿主的实验一般是不被允许的。自然界中这种突变发生的概率极低,但是影响却最为深远。
显性负突变,会产生与野生型基因拮抗的基因产物。这些突变通常会导致分子功能改变(通常是无活性的),并以显性或半显性表型为特征。
致死突变,是导致携带突变的生物体死亡的突变。
回复突变,是恢复原始序列并因此恢复原始表型的点突变。
病毒的突变可能会影响病毒复制所必需的蛋白质的编码以及RNA或DNA元件序列,因此,大量的突变往往是有害的——对病毒本身有害。这些含有有害突变的病毒不能复制自身,从而被淘汰了。
有害突变之外,还有相当一部分突变属于“同义突变”,即突变前后对病毒没有影响。最终,只有少数突变对病毒适应性具有正面作用,被富集和固定下来。
简而言之,病毒一直在随机突变,但很多突变会让病毒“死得更快”,只有少量突变会留存下来。
由于病毒基因组一般较短、信息冗余度很低,囿于病毒自身生存复制需求、宿主先天性免疫和适应性免疫压力的(适应性)筛选,病毒基因组的突变位点大部分集中在病毒基因组的某些区域——通常是其结构蛋白的抗原决定区域,因此,我们能够检测到的病毒突变在基因组上的分布是不均匀的。比如新冠病毒的大量突变就集中在它的刺突膜粒蛋白编码基因上。
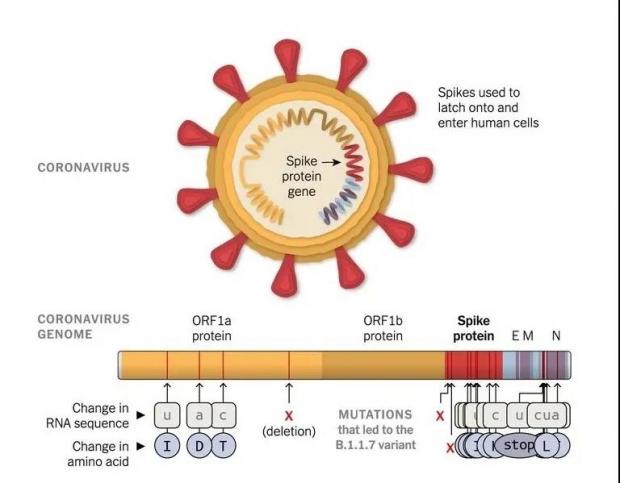
图5. 新冠病毒alpha株的基因突变位点示意图。图中最下边标记的就是突变,主要集中在后半段。来源 |《纽约时报》
病毒变异研究的重头戏是致病病毒抗原性的变化。“病毒抗原变异”有两个专有概念,分别为抗原漂移(antigenic drift)和抗原漂变(antigenic shift),前者是指较为细微的变化,而后者是指抗原性的巨大变化。当然,有些正向选择遗留下来的突变也存在于非编码区或者非结构蛋白编码区。
变种
新冠病毒还在不断变化,产生了新的变种(variant,又译作变异体)。变种病毒是指携带基因突变的病毒。如果突变足够多的话,可以根据序列差异将病毒划分为不同的基因型(genotype)、亚型、突变株等——划分的标准是序列差异大小,不同病毒的划分标准不尽相同。
其实,在同一患者体内感染的一种病毒,也在不断复制的过程中发生着各种突变,因此,体内不同病毒基因组分子的序列中也存在不同。换言之,一个患者体内会测出不同的病毒基因序列(详见《新冠变异株哪儿来的?慢性感染者竟可能是人体培养箱》)。
这种病毒以大量变种群体存在的形式称为准种(quasispecies)。上述已经存在的病毒基因型的划分,描述的是病毒的遗传多样性;而准种中正在产生的各种变种,描述的是病毒的高度变异性。遗传多样性是变异和自然筛选共同作用下病毒演化的结果。
目前我们发现的新冠病毒变异株还没到分家成“型”的地步,更算不上是新的病毒物种。只不过因为这些突变株对公共卫生构成的威胁更大——传染性更强,导致的症状更严重,或者对疫苗的抗性更强——需要引起人们足够的重视。
其中,已知四种变异毒株最令人关注,并被WHO列入需要重视的变种清单[8],
Alpha 变异毒株( B.1.1.7),最早在英国肯特郡发现,已传播到 50 多个国家/地区,有可能还在变异,
Beta 变异毒株(B.1.351),最早在南非发现,已扩散到至少 20 个其他国家/地区
Gamma 变异毒株(P.1),最早在巴西发现,已扩散到其他 10 多个国家/地区
Delta 变异毒株(B.1.617.2),最早在印度发现,已扩散至92个国家。
更具体的变种特性可以回顾《新冠病毒Delta变异株强势反击,防疫需借鉴疫苗的现实世界数据丨117三人行》。
目前闹的最凶的Delta毒株最早于2020年10月在印度被发现,这种新的变异毒株携带E484Q和L452R突变,可能导致免疫逃逸和传染性增强。世卫组织将其命名为B.1.617,2021年5月31日用希腊字母δ(Delta)命名。事实上,B.1.617总共包含15处突变,有6处发生在刺突蛋白上,其中又有3处比较关键:L452R和E484Q突变发生在刺突蛋白与人体细胞“血管紧张素转化酶2(ACE2)”受体结合的区域,L452R提高了病毒侵入细胞的能力,E484Q有助增强病毒的免疫逃逸;第三处突变P681R也能使病毒更有效地进入细胞。这些突变的综合效应使病毒能部分避开一些中和抗体,且传染性增强数倍[9]。
目前接种的疫苗还是有效的,至少可以预防重症和减少死亡。
现在我们知道,研发新冠病毒的药物或疫苗,病毒变异是必须考虑的问题,因为病毒变异会导致其药物敏感性和抗原性发生改变,从而影响药物治疗效果和疫苗保护效果。
有人问,病毒不是传染性越强,毒力越弱吗?为什么Delta都像水痘一样容易传播了,毒力却没变?(详见《袭击南京的Delta毒株,和水痘一样容易传染,一人可传八九人》)
病毒生存演化的方向应当是通过“优化”毒力“追求”更高的适应性,即病毒传播系数R0的最大化,而所谓毒力的“优化”,可能是毒力增强,也可能是毒力减弱。对于某个病毒而言,自然选择到底是增加还是减少病原体的毒力,具体取决于宿主、病毒和环境之间的特定组合。因此,病毒的演化不必然带来病毒毒力的增强;新冠病毒变异株传染性增强,也并不必然带来毒性增强或减弱。
“种”之“灭”,病毒能消灭吗?
传染病是由病原体引发的,因此可以通过根除病原体来根除传染病。事实上,人类也确实成功地消灭了一种可怕的传染病:天花。1980年5月8日,第33届世界卫生大会正式宣布:“世界各国人民赢得了胜利,根除了天花”。消灭天花这一人类壮举并非偶然达成,它的实现是一系列因素综合的结果:
1. 病原体只感染人,没有其他宿主或病毒储库。这就意味着只需要管好人就可以了,不需要处理难以控制的野生动物。
2. 感染后潜伏期短、发病快、症状明显。这意味着在监控传染源的时候非常容易鉴别诊断,不会出现难以防范的“默默散播病毒” 的无症状感染者。
3. 感染后自愈或接种疫苗后,可获得强烈、持久的免疫保护。这意味着可以通过疫苗有效地防控该疾病。
4. 病原体可变性差。这意味着“天花病毒”这个病原体不会较快出现抗原性、抗药性等突变,给现有的疫苗或药物防控效果制造麻烦。
5. 教育、社会心理、政府决策、国际合作,等政治、经济、社会条件。民众了解、社会重视,决策正确,全球一致行动。
总结下来,天花就是一个人尽皆知、凶神恶煞、却只有一招杀手锏、不知变化的铁憨憨。这种情况下,消灭病毒是可行的。
事实上,在与其他传染病的斗争中,人类也获得了极大的胜利,同时在消灭这些疾病的时候,因为某些原因,并未如期达成目标。例如脊髓灰质炎,目前仍然是阿富汗、巴基斯坦和尼日利亚的地方性流行病。世界卫生组织认为,只要还有一名儿童感染有脊灰病毒,所有国家的儿童就仍有感染该疾病的危险。
脊髓灰质炎病毒之所以没有被清除,是因为其不符合上面提到的第二条和第四条——脊灰病毒感染后可能只引起轻微腹泻而被忽视;弱毒活疫苗本身具有突变返强的能力。
人类在防治麻疹的过程中也获得了重大的胜利,根据麻疹病毒的特性,它也是一种有望被人类消灭的病毒,但是其不符合第五条:人们对麻疹并不怎么重视,毕竟多数情况下,麻疹不会引起严重的病症。
HIV和疟疾极难清除,是因为疫苗研发困难,以及病原体变异性造成治疗过程中的耐药性。至于禽流感,则因为存在野生动物宿主,要消除它简直难如登天。
非典型性肺炎SARS似乎已经销声匿迹了。这不禁让人不禁联想,新冠病毒能不能被清除呢?我们对照上面提到的5个条件来看一看:
1. 病原体只感染人?
看来并不是,新冠病毒可以感染除人以外的多种动物,但好在与人类接触十分密切的驯化动物不会造成严重的传染。
2. 感染后潜伏期短、发病快、症状明显?
并不是——感染新冠后,可能无症状或轻症,这部分人群难以检测和管理,使疫病防控困难。
3. 感染后自愈或接种疫苗可获得强烈、持久的免疫保护?
目前疫苗的有效性(主要是防止重症或死亡的保护率)得到检验和认可,但新冠病毒感染或接种疫苗之后的保护(不被再次感染的)效率及持续保护的时间还有待检验。
4. 病原体可变性差?
显然新冠病毒的可变性很强。变来变去,防不胜防。
5. 教育、社会心理、政府决策、国际合作……等政治、经济、社会条件能协作一致?
这一条在不同国家对抗疫情过程中有极其鲜明的对照,大家关注已久,应深有体会。
新冠病毒不是个蛮横铁憨憨,而是一个狡猾善变的滑头鬼。那我们到底是该“消灭”它,还是该与它“共存”呢?这要看主观上想不想,和客观上能不能。
主观上应该是“该消灭”,如果真有这么一个溜光锃亮的标语:“病毒也是生命,也有生存的权利”,这种病怕是没治。客观上能不能呢?就这种病毒来说,没有先例,困难重重,但非绝无希望,且这个“希望”是相信的人越多,则希望越大(任何疾病的清除都需要全球合作)。
既然有希望,便做么?这个就取决于权衡。譬如彩票,中奖是有概率的,代价似乎也不大,权衡之后,有人就去买,有人就不去买,这都很正常,但是如果中奖了,不管买不买,都羡慕。除中国外,世界上相当一部分人已经不得不被迫“与病毒共存”了。
我们能做什么?短期不求在全人类中消灭新冠病毒,至少一省、甚至一国,在相当一段时间内是可以达到“清零”的。退一万步讲,消除病毒的路线不成功,最终发展成为“事实共存”(疫苗或药物可用,病毒传播、致死率下降,但并未消失),再调整策略也不迟。
“我”虽为人类,人类不必在“我”,人类当然可以与病毒共存,且正在与很多病毒共存,但我不想成为被新冠病毒检验的人类,我该戴口罩戴口罩,改打疫苗打疫苗,该配合防疫工作就配合防疫工作。毕竟以“消灭病毒”之态度,保住了“我”的性命,才谈得上共存不共存。
参考文献
[1] Sorensen, Roy (2003). A Brief History of the Paradox: Philosophy and the Labyrinths of the Mind. Oxford: Oxford University Press. pp. 4–11.
[2] Benton, Michael J.; Donoghue, Philip C. J. (2007-01-01). "Paleontological Evidence to Date the Tree of Life". Molecular Biology and Evolution. 24 (1): 26–53.
[3] Benton, Michael J.; Donoghue, Philip C. J. (2007-01-01). "Paleontological Evidence to Date the Tree of Life". Molecular Biology and Evolution. 24 (1): 26–53. doi:10.1093/molbev/msl150. ISSN 0737-4038. PMID 17047029.
[4]
[5]
[6]
[7]
[8]
[9]
话题:
0
推荐
财新博客版权声明:财新博客所发布文章及图片之版权属博主本人及/或相关权利人所有,未经博主及/或相关权利人单独授权,任何网站、平面媒体不得予以转载。财新网对相关媒体的网站信息内容转载授权并不包括财新博客的文章及图片。博客文章均为作者个人观点,不代表财新网的立场和观点。




 京公网安备 11010502034662号
京公网安备 11010502034662号 