今天的人们似乎越来越对原子、分子习以为常,却忽视了这些概念并非理所当然。原子、分子从思辨走向科学,经历了跨越百年的追索。我们脚下的坦途,也曾布满歧路。
全文将分上下两篇推送,本文为上篇。介绍从道尔顿、阿伏伽德罗到坎尼扎罗,近代原子分子学说在化学领域的源流脉络。
撰文 | 郑超(中国科学院上海有机化学研究所研究员)
每一处细小的事实都在引导你提出崭新的理论;
每一点理论的思索都在提示你发现未见的事实。
Jac. Berzelius Bref (1914), i, Part 3
说起原子和分子,读者朋友们想必不会感到陌生。任何一种中学物理或者化学教科书都会提及:原子是构成物质的基本微粒,原子按照一定的规则彼此连接,就形成了保持物质化学性质的最小单元——分子。从教科书的拓展阅读材料中你还能了解到近代原子、分子理论的主要创立者:英国人道尔顿(J. Dalton,1766~1844)和意大利人阿伏伽德罗(A. Avogadro,1776~1856)。在如今的化学实验室中,我们借助X射线衍射技术可以测定晶体中分子的三维结构;使用扫描隧道显微镜能够观察,甚至操纵固体材料表面的原子。但是,假如你多一些好奇心,将不难发现这样的事实:这两种物质结构表征方法的发明时间远远晚于道尔顿和阿伏伽德罗的生平年代。那么,没有先进仪器的加持,一百多年前的先行者们在看不见、摸不着的“迷雾”中,究竟依靠着怎样的推理和实验才断定了原子和分子的存在,探听到从感官无法直接触及的微观世界中传来的阵阵春雷?
跳出藩篱的“嫁接”
原子、分子的思想由来已久,这从它们的词源可见一斑。英文“原子(atom)”一词来源于希腊语ἄτομον,意为不可分割;“分子(molecule)”则来源于拉丁语mōlēcula,意为一小堆物质。古希腊思想家留基伯(Leucippus)、德谟克利特(Democritus)和伊壁鸠鲁(Epicurus)都持有物质由不可分割的微粒所组成的观点,但是他们的论述显然无法脱离超验的哲学思辨范畴。紧随文艺复兴而来的科学革命让原子论焕发了新的生机。经典力学的巨大成功让十七世纪的自然哲学家普遍相信:宏观物体的运动行为一定能够归因于肉眼不可见的微粒的性质与相互作用。最具代表性的实例来自牛顿(I. Newton),他发现如果把气体看作由相互排斥的微粒所组成的弹性流体,并且斥力随着微粒间距的增大而迅速减小,这样的气体就将服从波意耳(R. Boyle)的实验定律(恒定温度下气体的压强与体积成反比)。在巨著《光学》的末尾,牛顿明确提出了物质是由具有一定质量且不可穿透的运动微粒所组成的假说,并希望以此为基础解释复杂的化学变化。不过牛顿同时也承认,他无法用实验证明这种微粒假说;把原子论从思维体操升华为科学理论的任务只能留待后人。
向牛顿指出的方向迈出决定性一步的后人正是道尔顿。牛顿去世40年后,道尔顿出生于英格兰北部一个贫苦的农民家庭。他自幼聪颖过人,却没能接受系统的学院教育,全靠自学成才。道尔顿一生未婚、不重名利,用做教师的微薄收入维持简朴的生活。他“午夜方睡,黎明即起”,把全部精力投入到对科学的探索中,研究领域涉及气象学、物理学和化学。道尔顿从21岁起每天清晨进行气象观测,直到他去世的前一天,前后持续57年之久。长期积累的关于气温、气压、湿度等的第一手资料成为他研究气体性质的重要基础。

J. Dalton(1766~1844)
十八世纪末,人们已经从空气中分离出氧气、氮气、碳酸气(二氧化碳)等多种气体,并测定了它们的密度。一个自然而又费解的问题是,这些组分为什么能够混合成均匀的空气,而没有依据各自的密度分层?此外,道尔顿通过实验发现了气体分压定律,即混合气体的总压强等于所有组分的压强之和。道尔顿沿着牛顿的思路,认为将气体看作由具备特定质量的原子所组成的弹性流体是解释上述事实的可行方案。不过,由于深受当时流行的“热质说”影响,道尔顿的原子被一层无质量的热流环绕,就像被棉花包裹的硬球一样。道尔顿进一步假设,同种原子的热流相互排斥、异种原子的热流没有相互作用。这样一来,不同气体的原子能够在彼此的热流之间穿梭,从而实现均匀的混合;排斥作用只发生在同种气体的热流之间,就“保证”了分压定律的成立。

图1.(左)道尔顿的著作《气象观测论文集》,其扉页上引用了古罗马诗人贺拉斯(Q. Horati Flacci)的诗句 Est quadam prodire tenus, si non datur ultra,大意为“如果不能再远些,总能到达某个点”;(右)道尔顿的原子模型(从中心辐射的线条表示原子周围的热流),其中编号为1、13和5的模型分别表示氢、氧和水“原子”
道尔顿真正超越牛顿及以往所有原子论者的地方,在于他将物理的原子论与化学反应的元素质量比巧妙地“嫁接”。道尔顿提出了著名的倍比定律:当两种元素A和B可以化合形成不同物质时,在这些物质中与一定质量A元素结合的B元素的质量成简单的整数比。例如沼气(甲烷)和油气(乙烯)都只含有碳、氢两种元素,如果以两种气体中碳元素的质量为基准,那么沼气中氢元素的质量是油气的两倍;类似地,碳氧化物(一氧化碳)中碳、氧元素的质量比为3:4,而碳酸气中这一比例恰为3:8。道尔顿敏锐地意识到,使用原子论可以完美地解释这一发现。既然原子不可分割,那么元素的彼此化合必然以各自的原子为最小单元。不同物质中元素质量比的简单倍数关系,不正好对应着参与化合的原子个数的差异吗?以这个发现为起点,道尔顿创造性地提出了一种计算原子相对质量(原子量)的方法。以氧为例,当时人们通过水的电解实验和氢气燃烧实验,已经知道水仅由氢和氧组成。道尔顿基于一种“最简比”原则,推定水是氢与氧的二元化合物,其化学式(用今天的记号表示)为HO,再将氢的原子量设为1,根据实验测定的水中氢和氧的质量分数即可算出氧的原子量。如果采用拉瓦锡(A. Lavoisier)的数值(氢和氧的质量分数分别为15%和85%),氧的原子量可定为5.7(≈ 85/15);如果采用盖–吕萨克(J. L. Gay-Lussac)和洪堡(A. von Humboldt)的数值(氢和氧的质量分数分别为12.6%和87.4%),氧的原子量则为7(≈ 87.4/12.6)。
1803年9月,道尔顿在实验日志中写下了第一张原子量表。当年10月,道尔顿在向曼彻斯特文哲学会宣读的一篇论文中,首次公开了他的原子论和原子量表。1808年,道尔顿出版了他的名著《化学哲学新体系》,在该书的第二部分中用原子论阐述了基本元素与二元素化合物的组成和性质。以今天的眼光看,道尔顿的原子论有太多的瑕疵。他笃信的热质说是完全错误的理论,确定物质化学式的方式也失之武断;他的实验技术并不高明,所收录的原子量(即使换算为正确的化学式)也有很大的误差。但是这丝毫不减损道尔顿在科学史上的地位。“原子论”是古老的,但是道尔顿第一个跳出哲学思辨的藩篱,既用原子论的观点解释物质的化学组成,又用可观测的实验现象论证原子的存在。正如当时的英国皇家学会会长戴维(H. Davy)所指出的,道尔顿所提出的科学原子论可以与开普勒(J. Kepler)在天文学上的功绩相媲美。他无愧于恩格斯所称赞的“近代化学之父”的美誉。
莫衷一是的混乱
道尔顿的原子论甫一问世,就受到了化学家们的广泛关注,但是同时也面临着严峻的挑战。问题的核心在于,道尔顿所计算的原子量强烈依赖于未经证明的化学式。例如,不论采用哪一组关于氢、氧元素质量分数的实验结果,如果把水的化学式从HO改为H2O,那么氧的原子量就会翻倍。如前文所述,道尔顿提出了“最简比”原则以应对这种不确定性。他认为由两种元素组成的物质中最稳定的那种一定是二元的(化学式为AB);而三元物质(化学式为AB2或者A2B)中由于同种原子的热流互相排斥,其稳定性必然会降低。道尔顿甚至进一步猜想,多元物质化学式的上限是AB12或者A12B,其依据是几何学中的最密堆积原理:一个球体最多可以与12个同样大小的球体接触(就像水果店里错落码放的橘子)。道尔顿的“最简比”原理虽然具有某种形式上的美感,却与许多实验事实不合。其中最著名的矛盾,来自盖–吕萨克和洪堡所发现的氢气与氧气反应时的简单体积比。
盖–吕萨克是十九世纪初法国首屈一指的物理学家和化学家。他早年求学于拉瓦锡的亲密合作者贝托莱(C. L. Berthollet),并继承了老师的衣钵。盖–吕萨克最著名的成就是以他的名字命名的物理定律:在恒定的压强下气体的体积随温度的上升线性膨胀。1804年,盖–吕萨克两次乘坐热气球升空(第一次与物理学家毕奥(J. B. Biot)同行),研究了大气温度、湿度以及地磁场随高度的变化规律。他是历史上第一个到达7000米高空的人。

左边:J. L. Gay-Lussac(1778~1850);右边:J. J. Berzelius(1779~1848)
在热气球探险结束后不久,盖–吕萨克和德国博物学家洪堡合作,深入研究了氢气与氧气的反应。借助伏打测气管(用水银将一定体积的氢氧混合气体密封于倒置的长管内,再用电火花引发氢氧反应,通过反应结束后水银液面的上升测定混合气体体积的减少量),他们发现气体的化学反应遵循简单的体积比:在一定的温度和压强下,2体积氢气和1体积氧气反应生成2体积水蒸气。这个简明的数学关系立刻让人意识到,体积可以作为气体参与化学反应的计量单位。如果承认化学反应以原子为基本单元进行,就不难得出以下推论:“在一定的温度和压强下,相同体积的任何气体的原子数相等”。
也许是出于对老师的维护(贝托莱始终反对不同元素按照一定计量比发生化学反应的观点),盖–吕萨克本人并未对氢氧反应体积比的意义做过多的阐述,不过这项实验结果对于道尔顿的冲击非同小可。从今天的视角来看,我们很容易认同“相同体积气体的原子数相等”这一论述在一定程度上同时支持了气体分压定律和原子论;但是道尔顿对此并不买账,反而质疑盖–吕萨克和洪堡实验结果的准确性。对于道尔顿而言,水作为氢与氧的“复合原子(compound atom)”,其原子量理应大于氧气(道尔顿认为水的化学式是HO,氧气的化学式是O),如果承认“相同体积气体的原子数相等”,那么水蒸气的密度也将大于氧气,而这显然与事实不符。因此,道尔顿坚持认为,由于原子周围环绕着无质量的热流,所以实验测定的气体密度(宏观性质)并不能与其原子量(微观性质)直接挂钩,相同体积的不同气体所含有的原子数也不必相等。更加严重的是,如果按照盖–吕萨克和洪堡的体积比配平氢气和氧气的反应方程式,那么水的化学式中必然出现“半个氧原子”:
2 H + 1 O → 2 HO1/2 (1)
这是信奉“物理原子论”的道尔顿无论如何也不能接受的!
设法调和这一冲突、并使原子论得到进一步发展的是瑞典化学家贝采利乌斯(J. J. Berzelius)。为了避免半个氧原子的尴尬,他提出不妨把水的化学式改为H2O,同时假定“相同体积气体的原子数相等”这一论断只适用于氢、氧等简单原子,而像水这样的复合原子则不必受其约束。据此,贝采利乌斯将(1)式改写为(2)式,暂时回避了矛盾。
2 H + 1 O → 1 H2O (2)

图2.(左)描绘盖–吕萨克与毕奥乘坐热气球升空的画作;(右)纪念贝采利乌斯的邮票
贝采利乌斯的科学生涯起于对电化学的研究。电解是当时化学家们了解复杂物质组成的重要手段。贝采利乌斯注意到,在电解实验中一些物质总是从阴极析出、而另一些从阳极析出,这使他相信物质的结合是由于不同电荷的相互吸引。贝采利乌斯进一步将物质的电性与酸碱性联系起来,构建了他关于无机物分类的理论体系——电化学二元论。他把电负性的氧化物(如氧化硫,SO3)归为酸、把电正性的氧化物(如氧化铜,CuO)归为碱,酸碱结合形成中性的盐(如硫酸铜,CuO•SO3或CuSO4)。贝采利乌斯仔细分析了一系列氧化物、硫化物和硫酸盐的组成,发现其中某些元素的质量分数经常呈固定的整数比:如硫化铜(CuS)与硫酸铜中铜和硫的质量比相等,硫酸铜与硫酸钡(BaSO4)、硫酸铅(PdSO4)中硫和氧的质量比相等;在铁的两种硫化物(FeS2和FeS)中硫的质量比为2:1(以铁为基准),在铜的两种氧化物(Cu2O和CuO)中氧的质量比为1:2(以铜为基准)。这些结果与道尔顿的倍比定律不谋而合。
受拿破仑战争的影响,十九世纪初欧洲各国科学家之间的交流并不顺畅。贝采利乌斯取得上述结果时并不知晓道尔顿的工作。他最早在1809年从英国化学家沃拉斯顿(W. H. Wollaston)的文章中初步了解到道尔顿的理论,但是迟至1812年才收到道尔顿寄给他的《化学哲学新体系》一书。贝采利乌斯在给友人的信中表示“没有一份礼物比这本书更让我高兴,不过我也毫不掩饰对其作者的失望”。贝采利乌斯虽然十分赞赏道尔顿原子论的思想,但是对他的实验数据之粗糙颇不以为然。从1814年起,贝采利乌斯开始了自己的原子量计算工作。他把氧的原子量定为100,再利用他积累的数千种无机物的成份分析结果、结合“类质同晶”等规律,计算了当时已知的49种元素中的45种原子量。贝采利乌斯是十九世纪上半叶最杰出的无机与分析化学家,他的实验以数据翔实可靠著称。他发明了使用元素符号和原子个数表示物质化学式的方法(如水写作H2O,与今天通行的记法只有上下标的区别),他的原子量表也极具影响力。
表1. 十九世纪初的各种原子量数值
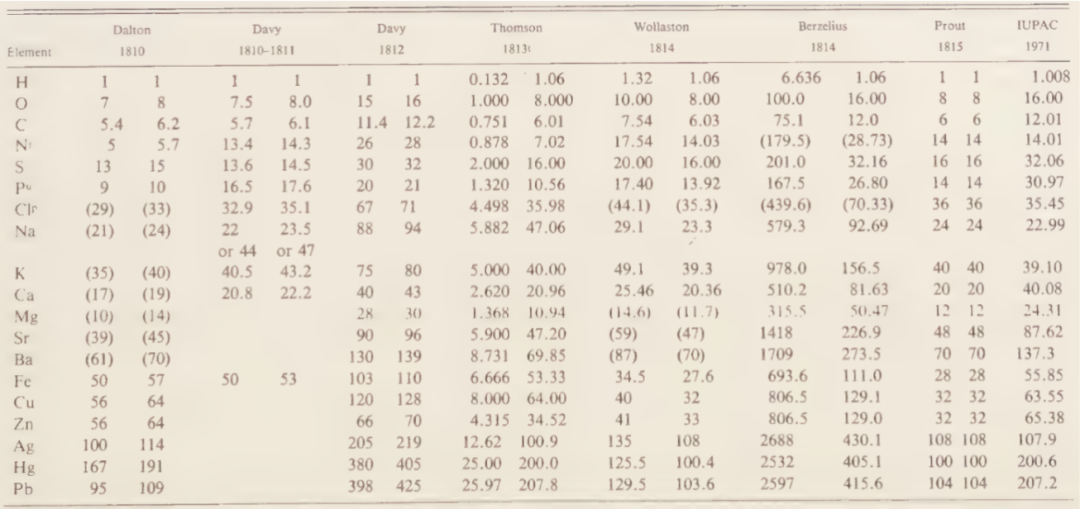
注:表中每组第二列是以O为8(水为HO)或16(水为H2O)为基准的换算值,最后一列为现代值。数据来源:Chemical Atomism in the Nineteenth Century.
尽管如此,贝采利乌斯仍然面临着和道尔顿相同的困难:物质化学式的推定缺乏充分的依据。贝采利乌斯把所有金属氧化物的化学式都定为MO或者MO2,这使得一些(常显低价的)金属原子量的计算值是正确值的2或4倍。除道尔顿和贝采利乌斯之外,戴维、沃拉斯顿、汤姆逊(T. Thomson,英国化学家)、普劳特(W. Prout,英国化学家)等人都对常见元素的原子量进行了计算。虽然计算原理基本相同,但是他们所采信的实验结果并不完全一致,所依据的一些关键物质的化学式也有差异,故而计算结果多有抵牾。这种莫衷一是的混乱局面对于原子论的发展产生了非常不利的影响。一些保守的化学家选择放弃虚无缥缈的“原子”,继续使用诸如“当量重量(equivalent weights)”等与实验联系更为紧密的概念来描述物质的组成与化学反应。
历史在这里和化学开了一个不大不小的玩笑。十九世纪二十年代的化学家们并不知道,破解谜题的钥匙早已出现,而这把钥匙的正确用法却还要等到几十年后的一个特别场合方才广为人知。
“不费工夫”的共识
1828年,贝采利乌斯的德国学生维勒(F. Wöhler)使用氰酸盐和氨水等无机物制备了有机物尿素,打破了有机物的合成必须依赖“生命力”的神话,揭开了近代有机化学的序幕。有机物虽然仅由碳、氢、氧、氮等少数几种元素组成,但是种类繁多,元素的含量比也变化多端。由于缺乏公认的原子量和确定物质化学式的方法,据当时的学者统计,连醋酸这样简单的有机物,竟也有多达19种不同的化学式!为了扭转这种混乱的局面,一场史无前例的国际化学会议于1860年9月3日至5日在德国南部城市卡尔斯鲁厄召开了。
卡尔斯鲁厄会议由德国化学家凯库勒(F. A. Kekulé)、维尔齐恩(C. Weltzien)和法国化学家武尔茨(C. A. Wurtz)发起,共有来自欧洲15个国家的140余位化学家参会,是历史上第一次国际学术会议。虽然经过了长时间的讨论,但是由于与会者反对举手投票的“民主”议事方法,这次会议并没有针对它的初衷——物质组成与化学反应的基本概念——形成任何决议。不过,在会议的最后一天,意大利化学家坎尼扎罗(S. Cannizzaro)在会场散发了他于两年前为热那亚大学的学生编写的一本讲义《化学哲学教程提要》,书中用严谨的逻辑和清晰的表述澄清了当时化学研究中最核心的疑难问题。

左边:A. Avogardro(1776~1856);右边:S. Cannizzaro(1826~1910)
坎尼扎罗的人生经历曲折而丰富。他成长于意大利的西西里岛,早年参加反抗波旁王朝统治的西西里独立革命,还担任过炮兵军官。后来辗转于意大利、法国多地求学并从事化学研究,发现了有机化学中著名的坎尼扎罗反应(苯甲醛在强碱性条件下歧化生成羧酸和醇)。坎尼扎罗在化学史上留下的最浓墨重彩的一笔,当属在卡尔斯鲁厄会议上传播分子学说。这套理论源于他的意大利前辈阿伏伽德罗于1811年发表的论文。阿伏伽德罗比坎尼扎罗年长50岁,和道尔顿、盖–吕萨克以及贝采利乌斯是同时代的人。他出生于一个显赫的法官家庭,年轻时做过多年律师,30岁开始研究自然科学,后来长期在家乡的都灵大学担任教授。阿伏伽德罗身处法语学术圈的边缘,生前在英语世界中并不知名(十九世纪初原子论的几位重要贡献者都是英国人,或者与英国学界联系密切)。阿伏伽德罗的分子学说在提出后的近半个世纪里都不受认可,但他自己并不介意。他一生的大部分时间都与家人过着宁静的生活。
阿伏伽德罗研究了盖–吕萨克和洪堡关于氢气和氧气反应的实验结果,他赞成把体积作为气体参与化学反应的计量单位这一观点。阿伏伽德罗提出只要把(1)式改写为(3)式,
2 H2 + 1 O2 → 2 H2O (3)
即把三种物质化学式中的原子数都乘以2,就既避免了“半个氧原子”的尴尬,又能符合实验测定的体积比;所付出的代价是承认氢气和氧气的微粒(阿伏伽德罗称作“构成分子”,molécule constituante)由两个相同的更小微粒(阿伏伽德罗称作“基本分子”,molécule élémentaire)组成。用今天的术语来说,阿伏伽德罗第一次区分了单质气体的原子(如O)和由两个原子组成的分子(如O2):分子由原子组成,保持物质的化学性质;在化学反应中分子可以被分割和重组,而原子则不能。这样,“等温等压下相同体积气体的原子数相等”这一论述自然被修正为等温等压下相同体积气体的分子数相等(今天被称为阿伏伽德罗定律)。由于把氧气视为双原子分子,即使在阿伏伽德罗定律的约束下,其密度大于水蒸气也不违和。从(1)式到(3)式的改动看似微不足道,而且调和了各方的矛盾,但在当时仍属冒天下之大不韪。因为无论是道尔顿的热流原子模型还是贝采利乌斯的电化学二元论,都不允许相互排斥的同种原子直接结合。热流原子模型虽然应者寥寥,但是电化学二元论在无机物的分类和成份分析中得到了广泛应用,甚至一度被奉为圭臬。因此,尽管与阿伏伽德罗类似的观点后来还曾被法国大科学家安培(A. M. Ampère)重新提出,却始终没有得到应有的重视。

图3. 阿伏伽德罗1811年论文的手稿,箭头所指是关于分子论述的起始处。丨图片来源:Amedeo Avogadro, A Scientific Biography
分子学说之所以能在坎尼扎罗的手中前进一大步,是因为他从物质蒸气密度和元素质量比这两种宏观可测的性质出发,建立了推导物质分子量、分子式以及元素原子量的完整逻辑链条。他将氢(H)的原子量设为1,依据阿伏伽德罗对氢氧反应体积比的解读,氢气(H2)的分子量为2。只要承认等温等压下相同体积气体的分子数相等,物质的蒸气密度就能作为其分子量的度量。将一系列气体物质的密度与氢气密度相比,即可推定它们的分子量。如氧气为32、碳氧化物和碳酸气分别为28和44、氯气为71、盐酸气为36.5、汞蒸气为200、甘汞和升汞蒸气分别为235.5和271。注意到分子中各元素对分子量的贡献值一定是其原子量的整数倍,那么根据物质中各元素的质量比可以确定其化学式和相应元素的原子量。如氧气的化学式为O2,氧的原子量为16(16 × 2 = 32);碳氧化物和碳酸气的化学式分别为CO(16 + 12 = 28)和CO2(12 + 16 × 2 = 44),碳的原子量为12;盐酸气和氯气的化学式分别为HCl(1 + 35.5 =36.5)和Cl2(35.5 × 2 = 71),氯的原子量为35.5;甘汞和升汞的化学式分别为HgCl(200 + 35.5 = 235.5)和HgCl2(200 + 35.5 × 2= 271),汞的原子量为200。
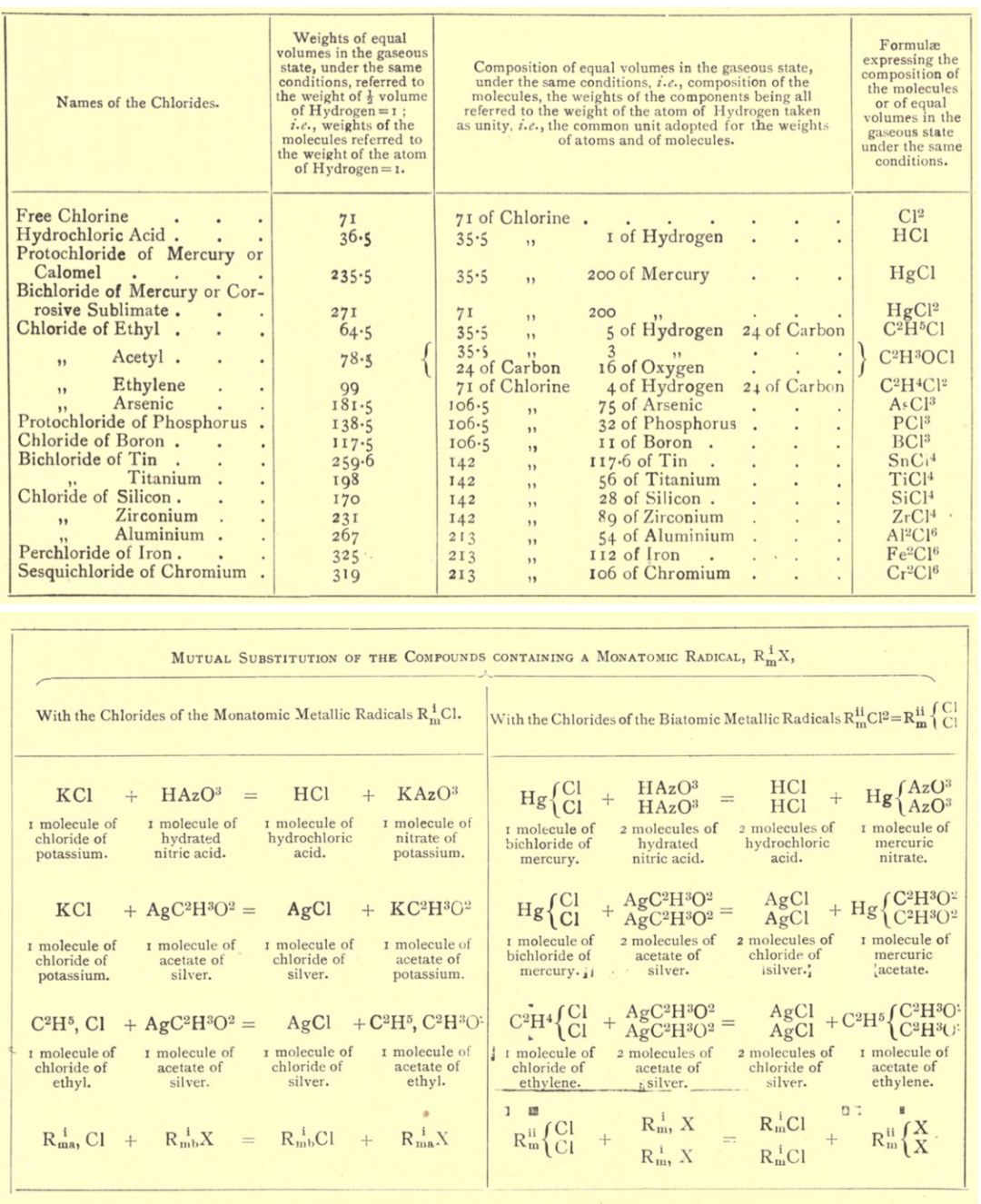
图4. 坎尼扎罗关于氯化物的分子式、分子量和反应方程式,与今天的记法已经十分接近。图片来源:Sketch of a Course of Chemical Philosophy
由于有机物的蒸气密度和元素组成通常可以比较方便地测定,因而坎尼扎罗的方法迅速驱散了笼罩在有机物化学式问题上的疑云,给出确定并且自洽的答案。对于无法测定蒸气密度的物质,坎尼扎罗依据关于晶体比热的杜隆–珀蒂定律(Dulong–Petit law)辅助确定化学式中包含原子的总数,也能得出令人满意的结果。“踏破铁鞋无觅处,得来全不费工夫”。坎尼扎罗如同水银泻地般的精彩推理征服了许多即将离开卡尔斯鲁厄的与会者。德国化学家迈耶尔(J. L. Meyer)赞叹道“原来的茫然一下子就被剥除了”。自此,将原子和分子的概念应用于物质组成和化学反应的研究便再无障碍,各种关于原子量数值的冲突也迎刃而解。年轻的俄国化学家门捷列夫(D. I. Mendeleev)——在卡尔斯鲁厄会议上他还只是一名默默无闻的留学生——正是按照原子量由小到大的顺序将不同元素依次排列,终于在九年后发表了伟大的元素周期律。
未完待续
从道尔顿、阿伏伽德罗到坎尼扎罗,近代原子、分子学说在经历了十九世纪前半叶的迷茫和混乱后,终于在化学理论体系中赢得了稳固的一席之地。然而原子和分子真的是客观存在的微小实体吗?或者只是人为构建的理想模型?围绕这个问题,更多的探索和争论将在化学之外展开。它催生了新的学科,革新了人们的认知,更塑造了二十世纪科学的底层逻辑……
参考文献
[1] J. R. Partington, Ann. Sci. 1939, 4, 2435.
[2] A. J. Ihde, J. Chem. Educ. 1961, 38, 83.
[3] S. G. Brush, Synthese 1968, 18, 192.
[4] A. J. Rocke, Hist. Stud. Phys. Sci. 1978, 9, 225.
[5] W. W. Porterfield, J. Chem. Educ. 1995, 72, 871.
[6] M. C. Usselman, D. G. Leaist, K. D. Watson, ChemPhysChem 2008, 9, 106.
[7] M. C. Usselman, T. A. Brown, Ann. Sci. 2015, 72, 153.
[8] M. I. Grossman, Brit. J. Hist. Sci. 2017, 50, 657.
[9] Y. Xu, Y. Tong, J. Yuan, Found. Chem. 2023, 25, 439.
[10] D. S. L. Cardwell, Ed. John Dalton & The Progress of Science. Manchester University Press, 1966.
[11] A. J. Rocke, Chemical Atomism in the Nineteen Century – From Dalton to Cannizzaro. Ohio State University Press, 1984.
[12] C. Cercignani, Ludwig Boltztnann The Man Who Trusted Atoms. Oxford University Press, 1998.
[13] P. Achinstein, Book of Evidence. Oxford University Press, 2001.
[14] P. Grapí, Inspiring Air: A History of Air-related Science. Vernon Press, 2019.
[15] R. Seth, G. E. Smith, Brownian Motion and Molecular Reality. Oxford University Press, 2020.
[16] 李醒民,《自然辩证法通讯》,1988年,第10卷,57页。
[17] 刘立,《大学化学》,1989年,第4卷,61页。
[18] 沈乃澂,《物理》,2018年,第47卷,648页。
[19] 王竹溪著,《热力学》,高等教育出版社,1955年。
[20] 道尔顿著,李家玉、盛根玉译,《化学哲学新体系》,北京大学出版社,2006年。
[21] 牛顿著,周岳明、舒幼生、邢峰、熊汉富译,徐克明校,《牛顿光学》(第二版),北京大学出版社,2011年。
[22] 贺拉斯著,李永毅译注,《贺拉斯诗全集——拉中对照详注本》,中国青年出版社,2017年。
致谢
作者感谢中国科学院上海有机化学研究所游书力院士、中国科学院物理研究所曹则贤研究员、上海交通大学张绍东教授和中国科学院自然科学史研究所刘金岩研究员对本文的宝贵意见。
作者简介
郑超博士,中国科学院上海有机化学研究所研究员,国家自然科学基金委员会优秀青年科学基金项目获得者。研究方向为物理有机化学与手性合成。
0
推荐




 京公网安备 11010502034662号
京公网安备 11010502034662号 