尽可能让大家理解疫苗的作用机制,尽可能公布疫苗接种的相关数据,让大家明白疫苗带来的获益远高于风险,是增强对免疫接种信心的重点。
撰文 | 阿拉蕾(同济大学医学院内科学硕士)
2021年2月25日,又有2款国产新冠疫苗获得国家药品监督管理局(NMPA)批准上市,分别是康希诺生物股份公司的重组新型冠状病毒疫苗(5型腺病毒载体)和国药中生武汉公司的新型冠状病毒灭活疫苗(Vero细胞)。截至目前,我国已经官宣了4款新冠疫苗。同日,复星医药和BioNTech公司的mRNA新冠疫苗(注:即辉瑞/BioNTech的mRNA疫苗,复星医药获得该疫苗在中国的授权)也获得中国澳门特别行政区卫生局特别许可进口批准。随着多款新冠疫苗相继获批,人类在抗击新冠疫情方面将迎来新的局面。
国内外已经有相当数量的人群接种了新冠疫苗,有效性和安全性的数据也相继公布,结果理想。但是,对于更多的人们来说,与疫苗的保护力相比,疫苗不良反应、尤其是严重不良反应的报道更容易触动神经。打,还是不打,这是个问题!
接种疫苗为何会出现不良反应?
那还要先从免疫的种类说起
免疫的种类可以分为两大类:
一、非特异性免疫
又称天然免疫或先天免疫,它是机体生来就有的天然防御机制,不是某一个体所特有的,也不是专门针对某一个抗原性“异物”发挥作用。这种类型的免疫“不长记性”,如果再次接触同一抗原,会出现相似的反应。我们称为“缺乏免疫记忆”。
非特异性免疫系统包括:1、皮肤、黏膜等免疫屏障;2、溶菌酶、急性期蛋白、补体、细胞因子等免疫分子;3、吞噬细胞、单核细胞等免疫细胞。
二、特异性免疫
所谓“特异性”,就是“专门针对”的意思。淋巴细胞能够特异性地识别抗原性“异物”,然后其自身活化、增生和分化,分泌特异性抗体,清除“异物”以及受损的细胞。
这是一种后天获得的免疫,分为细胞免疫和体液免疫。前者由T淋巴细胞介导;后者由抗体介导。抗体是B淋巴细胞合成和分泌的免疫效应分子。
接种疫苗后的免疫反应,就是让人体产生对某种特殊病原微生物的特异性抵抗力,并有免疫记忆。也就是说,人体能“记住”自己得过的病,再次接触同一抗原后,能引起快速、强烈的免疫反应,从而发挥保护效力。
接种疫苗后的不良反应,也从免疫的两种类型来说
一、非特异性免疫损害
在接种疫苗后,有些人注射的地方会红肿,淋巴结会肿大、疼痛、有硬结;还有的人会发热、头痛、头晕、乏力、全身不适。这些局部的或全身性的炎症反应,都属于接种疫苗后的非特异性免疫损害。
这是因为,传统的疫苗大多数是对病原微生物或其糖分子、蛋白质分子亚单位进行灭活、减毒、提纯等方法制成的,所以这些疫苗本身就包含一些固有的生物学特性,比如有毒性、含有菌体蛋白以及代谢产物,这样就可能引发非特异性免疫反应。
此外,在疫苗产品中,除了病原微生物或其亚单位成分,还会包含稳定剂、防腐剂、吸附剂等。对于人体来说,这些都是“外来异物”,都有可能引起非特异性免疫反应。
二、特异性免疫损害
既然有非特异性的,自然也有特异性的免疫损害。它的学名叫超敏反应,也称变态反应、过敏反应。
正常情况下,人体的特异性免疫系统在接触“外来异物”后,可以清除“外来异物”,同时也能保持内环境的相对稳定。超敏反应,顾名思义,就是对外来异物的反应过度,结果引发生理功能紊乱或组织细胞损伤。超敏反应,通常是人体对抗原初次应答后,再次接触相同抗原后所引起的反应。
超敏反应的具体发病机制较为复杂,临床表现各异。简单来说,从疫苗接种后几秒钟、几小时、几天、甚至几周,都可能会发生超敏反应,可以表现为皮疹、过敏性鼻炎、荨麻疹、瘙痒等,严重时可出现喉头水肿、过敏性休克,甚至死亡。
第一个问题来了,超敏反应是“再次接触相同抗原后”才会引起的反应,为何有些人第一次接种疫苗后就会发生超敏反应呢?
的确,如果一个人没有接触过某一种病原体,那基本上不会对该病原体发生超敏反应。因此,除了极少的特殊情况外,第一次接种疫苗后出现的超敏反应,一般和疫苗中的病原微生物或其亚单位成分无关,而是由疫苗产品中的其他成分所导致的。上文中也已经提到,疫苗产品中还会包含稳定剂、吸附剂、防腐剂等,那主要都包含哪些成分呢?
-
培养基:部分疫苗是以鸡蛋或鸡胚为培养基制备的,因此对鸡蛋过敏的人群接种后会出现超敏反应。
-
明胶:明胶是许多疫苗的增容剂和热稳定剂,由动物胶原水解得到,来源于牛、猪等动物的皮、骨、腱等。
-
硫柳汞:硫柳汞是一种含乙基汞的有机化合物,自20世纪30年代起被广泛用作疫苗的防腐剂。
-
抗生素:部分疫苗含有微量的抗生素,例如新霉素、链霉素、多粘菌素等。
-
乳胶:主要存在于疫苗产品的容器或注射器中,乳胶含有植物蛋白和肽类杂质,可导致超敏反应。
-
佐剂:佐剂是指能与抗原结合,促进抗原作用的非特异性免疫增强剂,常用的有铝盐、皂苷(QS-21)、胞壁酸二肽/三肽、单磷酸脂质A、细胞因子等。疫苗产品中使用的佐剂不一定是单种成分,也可以是多种成分复配后获得。(详细了解可阅读《疫苗中的奇妙成分》)
除了以上谈及的传统疫苗,今年还有两种新的疫苗:mRNA疫苗和腺病毒载体疫苗。
从理论上来说,mRNA本身不会引起特异性免疫。那么,除了mRNA以外,疫苗中还有哪些成分呢?根据辉瑞和BioNTech向美国食品和药品监督管理局(FDA)提交的信息,我们得知,这款mRNA疫苗中还包括脂质纳米颗粒(LNP)(注:将mRNA运送到人体内的载体物质)以及一些化学物质,包括氯化钾、磷酸二氢钾、氯化钠、磷酸氢二钠二水合物和蔗糖,并且不含有鸡蛋成分、防腐剂、乳胶等。[1]
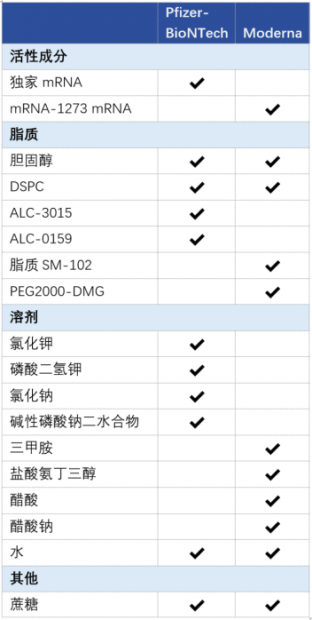
Pfizer-BioNTech与Moderna疫苗的成分比较[2](作者汉化)
腺病毒载体疫苗的情况则较为复杂。腺病毒是一种无包膜的双链DNA病毒,可以感染呼吸道、眼部、胃肠道,免疫功能正常的人感染后,多数可以自我恢复。全球范围内,已经有相当比例的人群体内存在腺病毒抗体,就是说已经具有预先存在的免疫力。“预存免疫”是否会影响疫苗的效果,也是领域内所关注的问题。
不过,腺病毒载体本质上还是“外来异物”,是能够刺激人体产生非特异性/特异性免疫反应的。2021年2月27日,美国FDA批准了强生公司的腺病毒载体新冠疫苗,根据FDA公布的信息,除了载体以外,包括一水柠檬酸、柠檬酸钠二水合物、乙醇、2-羟丙基-β-环糊精(HBCD)、聚山梨酯-80、氯化钠,同样不含有鸡蛋成分、防腐剂和乳胶[3]。2021年3月11日,强生公司的腺病毒疫苗在欧盟也获得批准。康希诺腺病毒新冠疫苗的其余成分信息较少。
第二个问题也来了,部分疫苗需要接种多次(注:包括科兴新冠灭活疫苗和复星新冠mRNA疫苗),如果接种第一针时,没有出现明显的不良反应,那第二针会有不良反应吗?
答案是:也有可能!
不论是疫苗的病原微生物或其组分本身,还是疫苗中的其他成分,都可能成为致敏原。阿瑟氏(Arthus)反应,就是多次重复接种疫苗时可能会出现的一种超敏反应。由于再次注射相同抗原,抗原和抗体结合,形成免疫复合物,中性粒细胞与免疫复合物发生反应,释放损伤性物质,破坏周围的组织。如果免疫复合物沉积在皮肤,会使皮肤发红、水肿、甚至坏死。
由此可见,第二次接种后的反应同样需要关注!
是否会出现不良反应,不良反应的严重程度,还与个体因素有关
为什么接种疫苗后会发生不良反应?原因十分复杂。除了疫苗产品本身以外,还与人体生理因素和健康状况有一定的关系。
在健康状况较差的情况下接种疫苗,例如,接种者有重度营养不良、消耗性疾病等,容易发生不良反应。
接种疫苗后进行剧烈运动和重度体力活动后,可能会加重不良反应。
接种疫苗后饮酒、睡眠不足等也可能会加重不良反应。
而存在免疫异常的人群,例如患有免疫缺陷症、HIV感染者、器官或造血干细胞移植者、使用免疫抑制剂者等等,在接种疫苗前都需要进行更详细的评估。
看到这里,会发现可能引起疫苗不良反应的因素还挺多。但事实上,不同的疫苗产品包含的成分不完全相同,而每一种疫苗中所含成分的种类有限,对这些成分会出现过敏的人数有限,因此最终出现不良反应的比例极低。
另一方面,“抛开剂量谈毒性,都是耍流氓”,疫苗中过敏源的含量一般很低,只有对这些过敏源有很强反应的人,才可能会在接种后出现过敏症状。
要想充分了解疫苗的不良反应
监测很重要!
相比其他药品,社会各界对疫苗安全性监测的要求更高。世界卫生组织(WHO)在《免疫接种安全性监测》中,对“预防接种不良事件”(adverse event following immunization, AEFI)的定义为:预防接种后发生的、被认为由预防接种引起的任何不良反应。
AEFI可能是真正的不良反应,确实是疫苗或免疫接种过程中引起的结果;也可能是偶合症,即,并非是由疫苗或免疫接种过程引起,而仅在事件上与免疫接种有关。
WHO将AEFI分为5类:
1、疫苗反应:由疫苗的某些成分(疫苗本身的活性成分、防腐剂、稳定剂等)引起的事件。
2、实施差错:疫苗制备、管理或接种过程差错引起的事件。
3、偶合事件:发生于接种后,但不是由疫苗或实施引起的事件。
4、注射反应:对注射本身焦虑,而非疫苗引起的事件。
5、原因不明的反应:原因无法确定的事件。
AEFI监测是各国卫生部门、疫苗生产企业、销售企业、疾控机构和接种单位的共同职责,各国都建立了各自的AEFI报告体系。建立和完善AEFI监测系统,尽可能收集疫苗在应用过程中发生的不良事件信息,可以有效评价上市疫苗的安全性,也可以增强公众对预防接种的信心。
根据识别和报告AEFI方式的不同,可将AEFI监测分为被动监测和主动监测两类。被动监测是由医务人员或公众报告任何怀疑与疫苗有关的不良事件;主动监测是通过系统地查找目标人群中的AEFI病例,获得AEFI的发生情况及发生率。后者多在疫苗临床研究或专题调查中采用。
在实际工作中,两种监测方法会综合运用。例如,我国设有急性弛缓性麻痹监测系统,既有常规病例因症状就诊时的医务人员被动报告,也有疾控机构人员定期到医疗机构开展的主动调查。
我国于2005年6月1日正式实施《疫苗流通和预防接种管理条例》。2010年《全国疑似预防接种异常反应监测方案》(以下简称《监测方案》)下发后,中国AEFI监测的工作日趋规范。我国《监测方案》对AEFI的分类与WHO有所不同:
1、不良反应:合格的疫苗在实施规范接种后,发生与预防接种目的无关或意外的有害反应,包括一般反应和异常反应。
-
一般反应:在预防接种后发生的,由疫苗本身所固有的特性引起的,对机体只会造成一过性生理功能障碍的反应,不会留下任何后遗症。(注:主要包括发热、乏力、局部红肿、疼痛等非特异性免疫损害)
-
异常反应:合格的疫苗,在实施规范接种过程中或者实施规范接种后,造成受种者机体组织器官、功能损害,相关各方均无过错的药品不良反应。(注:异常反应以超敏反应最常见)
2、疫苗质量事故:由于疫苗质量不合格,接种后造成受种者机体组织器官、功能损害。
3、接种事故:在预防接种实施过程中,违反预防接种工作规范、免疫程序、疫苗使用指导原则、接种方案,造成受种者机体组织器官、功能损害。
4、心因性反应:在预防接种实施过程中或接种后,因受种者心理因素发生的个体或者群体的反应。
5、偶合症:受种者在接种时正处于某种疾病的潜伏期或前驱期,接种后巧合发病。
从上面的AEFI监测分类,我们可以看出,严格意义上,AEFI的分类有许多种。而狭义上的AEFI,主要就是指WHO分类中的“疫苗反应”或者我国《监测方案》中的“不良反应”。
全球范围内,以美国的疫苗监测体系较为完善。美国疫苗上市后不良事件监测工作开始于20世纪60年代。1990年,美国疾病预防和控制中心CDC与FDA联合建立了疫苗不良事件报告系统VAERS(The Vaccine Adverse Event Reporting System,VAERS),由两个部门协作管理。
VAERS是一个疫苗上市后安全监测的自愿报告系统,其接收的报告主要来源于:疫苗生产者、医疗卫生从业人员、国家免疫计划、疫苗接种者(或其家人/监护人),也有其他信息来源。报告者可以直接通过官方网站下载VAERS表格报告,也可以拨打电话获得VAERS表格,或使用表格的复印件,所有数据都被收集到VAERS数据库中。其中,美国对严重不良事件的定义是:①引起死亡,②危及生命,③导致住院或延长住院时间,或④造成永久性丧残。
我国的AEFI监测工作由国家卫生主管部门和药品监督管理部门共同负责。报告实行属地化管理。医疗机构、接种单位、疾病预防控制机构、药品不良反应监测机构、疫苗生产企业等责任报告单位和报告人发现AEFI后,及时向所在地的县(区、市、旗,下同)级疾病预防控制中心(CDC)报告,县级CDC将AEFI个案报告卡和调查表信息通过全国AEFI信息管理系统进行网络报告,具有报告条件的接种单位可以直接将AEFI个案报告卡信息录入全国AEFI信息管理系统。我国对严重AEFI的定义与美国基本相同:是指导致死亡、危及生命、导致永久或显著的伤残或器官功能损伤的AEFI。
新冠疫苗的不良事件发生率究竟有多少呢?
目前,在我国获批的新冠疫苗中,以复星医药的mRNA新冠疫苗(注:即辉瑞/BioNTech的BNT162b2 mRNA疫苗)的数据较为完善。2020年11月,《新英格兰医学杂志》发表BNT162b2 mRNA疫苗的II/III期临床试验结果[4]。
试验最终纳入年龄≥16岁的43,448名受试者,按1:1分为mRNA疫苗组(21,720名)和安慰剂组(21,728名)。局部和全身反应的评估数据如下:
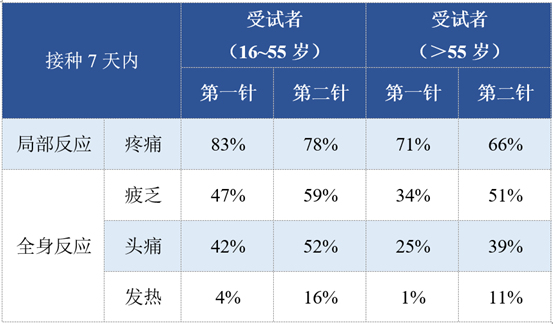
可见注射疫苗后最常见的局部不良反应是注射部位疼痛,而全身反应常为疲乏和头痛(注:这两者都属于非特异性免疫反应),年龄较长者的反应发生率均低于年龄较轻者。局部反应多为轻中度,1~2天好转。全身反应方面,0.2%的患者接种第一针后出现高热(38.9℃~40℃),0.8%的患者接种第二针后出现高热,有2名患者发热超过40℃。发热和寒战多在接种后1~2天内出现,症状可在短期内缓解。
对所有受试者进行不良事件监测,疫苗接种组中,有27%的受试者报告了不良事件(任何形式),很大部分是接种后短时间的局部或全身反应。有64名(0.3%)疫苗组受试者报告了淋巴结病;疫苗组出现4例严重不良事件(疫苗相关的肩部损伤、右腋窝淋巴结病、阵发性室性心律失常、右下肢感觉异常),2例受试者死亡,研究者调查后表示与接种疫苗无关。
随着接种mRNA疫苗人数的增加,相关数据也日趋完善,美国CDC还开发了一款APP来帮助疫苗接种后的监测(v-safe)。

2021年1月27日,美国CDC发布了VAERS最新的新冠疫苗安全性监测数据[5],部分数据如下:
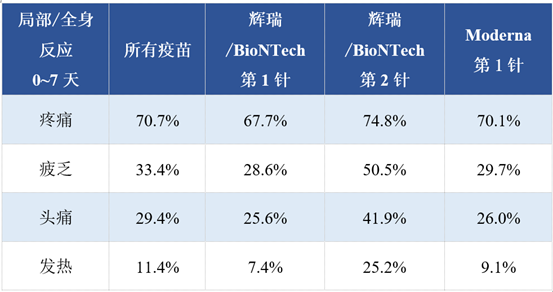
根据VAERS的数据,每百万次注射mRNA新冠疫苗,约有372次出现不严重的过敏事件(0.0372%)。结合上面的局部和全身反应数据,我们可以看出,多低于临床试验的结果。这种情况很大程度上和“被动监测”这种方式有关。举例来说,如果接种疫苗后出现轻度、短暂的局部疼痛或疲乏,经过休息后就能好转,这时候,部分接种者并不会去报告。因此,不良事件发生率的估计,以临床试验或专题调查数据更为准确,它们均是在研究者的密切观察下进行,是“主动监测”。VAERS也鼓励医生和其他疫苗相关人员报告不良事件,以获得更可靠的数据。
2021年2月16日,Nature网站发布文章[6],讨论了新冠疫苗不良反应的相关问题。对于罕见但严重的过敏反应,我们到底了解多少?
根据VAERS数据,Moderna mRNA疫苗每百万剂可出现3次严重的过敏事件(0.0003%),辉瑞/BioNTech mRNA疫苗每百万剂可出现5次严重的过敏事件(0.0005%),对于牛津-阿斯利康疫苗(腺病毒载体疫苗),在截止目前的300多万例接种中,已经证实有30例严重过敏反应。
近两日,丹麦报道有接种牛津阿斯利康腺病毒新冠疫苗者出现严重血栓事件,多国暂停接种该疫苗,引发各界担忧。为此,3月11日,欧洲药品管理局(EMA)表示,目前尚没有证据表明血栓事件与疫苗接种有关,在接种疫苗人群中发生血栓事件的数量不高于普通人群中的数量。EMA药物警戒风险评估委员会(PRAC)已经在审查阿斯利康疫苗的血栓不良事件,但是也表示由于疫苗的获益高于风险,故在血栓事件调查期间,该疫苗仍可以使用。[7]
这些疫苗引起过敏反应的具体原因尚不清楚,美国国家过敏和传染病研究所(National Institute of Allergy and Infectious Diseases, NIAID)已经设计了一项临床试验来明确潜在的原因。研究人员怀疑,脂质纳米颗粒(LNP)中含有的聚乙二醇(PEG)可能是引起过敏反应的物质。目前没有直接归因于新冠疫苗的死亡事件。
严重不良事件发生率到底高不高?那要和既往常用的疫苗比一比!
首先,让我们来看看国内几种常用疫苗的严重不良事件发生率[8]。
中国2016年不同疫苗AEFI分类报告结果(部分)
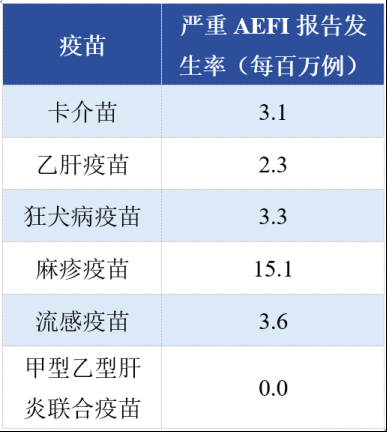
注:原表格是以每10万例为单位,为了和其他研究的数据统一,方便阅读,这里改为了每百万例为单位。
根据2016年中国疑似预防接种异常反应监测数据分析显示,AEFI总报告发生率为390.1/百万例(包括一般反应和异常反应,0.03901%),其中严重AEFI发生率为1.6/百万例(0.00016%)。
再来看一项全球性的研究数据[9]。
2009年~2011年间的25,173,965例疫苗接种,共确认33例严重过敏反应(注:该研究中对严重过敏反应的定义,是指急性、全身性、多器官系统受累、具有潜在致命性的过敏反应),发生率约为1.31/每百万接种(0.00013%)。数据如下:
全球几种常用疫苗的严重超敏反应的发生率(部分)
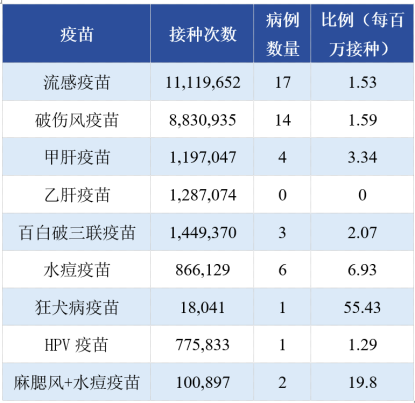
而上文中提到,根据VAERS检测数据,注射mRNA新冠疫苗的严重不良事件发生率为0.0003%~0.0005%,因此,mRNA疫苗的严重不良事件发生率高于既往常用疫苗的总体水平。
但是,不同的疫苗,严重AEFI的发生率也存在一定差异,mRNA疫苗并没有超过既往单个疫苗的高值。当然,由于mRNA疫苗的应用时间尚短,它的长期安全性等尚未解答的问题,还需要经历更长的考验。
相比mRNA疫苗,重组腺病毒载体疫苗和灭活疫苗的大样本量、完整公布的数据较少,这里就分享两个正式发表的数据。2020年8月,重组腺病毒载体新冠疫苗的II期临床试验结果发表在《柳叶刀》[10],共纳入508名符合要求的志愿者,其中253人接种高剂量疫苗(1×1011 病毒颗粒),129人接种低剂量疫苗(5×1010 病毒颗粒),126人接种安慰剂。不良事件评估主要结果如下:
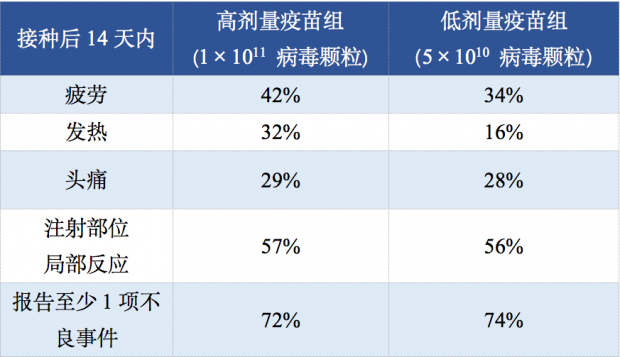
注:未发现严重不良事件发生。
科兴的新冠灭活疫苗I/II期临床试验结果,于2021年2月在《柳叶刀·感染》(Lancet infection)上公布[11]。试验纳入≥60岁的健康志愿者,观察期为28天,给予患者3种不同的接种剂量,分别为1.5 μg组、3 μg组、6 μg组。安全性结果显示每组出现任何不良事件的发生率分别为:
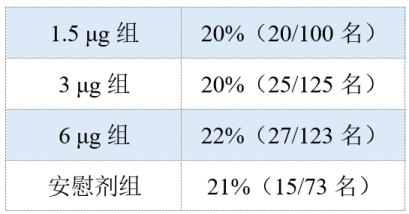
所有不良事件均为轻中度,注射部位疼痛是最常见的症状,发生率为9%(39/421名),发热的发生率为3%(14名/421名),同时未见有疫苗相关的严重不良事件发生。
严重过敏反应的发生率极低,一般反应似乎也不少,如果出现不良反应,该如何应对?
一、一般反应
1、局部反应,包括注射部位的疼痛、红肿等,多在注射疫苗12~24小时出现,红肿范围一般不大,仅有少数人红肿直径>5 cm,这种情况一般在24~48小时逐步消退。轻度的局部反应无需处理,红肿的早期可以局部冷敷,减少组织充血。
2、全身反应,包括发热、疲乏等,一般持续1~2天,少数患者还会出现恶心、呕吐、腹泻等胃肠道症状,一般接种当天多见,很少有持续2~3天的。发生轻度的全身反应后,加强观察,一般不需要特殊处理,适当休息,多喝开水,注意保暖。症状较重者,可以根据情况使用退热剂等药物,必要时送医院观察治疗。
二、异常反应(主要就是指过敏反应)
1、症状较轻者观察即可,无需用药。如果出现瘙痒、皮肤潮红、荨麻疹等,医生会根据情况给予患者口服抗组胺药H2受体拮抗剂、糖皮质激素等治疗;如果出现支气管痉挛的症状,例如胸闷、憋气等,可吸入短效β2受体激动剂,并联系转急诊中心继续观察治疗。除了上述的症状,还可能发生湿疹、水肿、紫癜等,一般无明显急性不适症状,无需采取紧急措施,可根据情况安排患者至相应专科就诊。
2、急性严重的过敏反应,即过敏性休克:及其罕见,但是一旦发生,可危及生命。主要表现为低血压、大汗、皮肤苍白、呼吸困难、晕厥、意识不清等,发展非常迅速,可在疫苗接种后几分钟内发生,多在30分钟内,极少超过1小时,这也是为何要求在接种疫苗后留观至少30分钟。
如果发生过敏性休克,肾上腺素是最优先紧急处理的药物,同时需维持气道和呼吸,监护输液等。部分疫苗接种点的紧急医疗保障能力有限,需在保证紧急抢救的情况下,转去急诊医疗中心继续治疗。
3、其他较严重的过敏反应是十分罕见的。例如过敏性紫癜、Arthus反应、吉兰巴雷综合征、脑脊髓膜炎等,可在接种后数日或数周发病。一旦发病,需要去相应专科评估就诊和治疗。
疫苗在人类和疾病的抗争中扮演了举足轻重的角色,是举世公认的最经济、方便、有效的预防和控制传染病的手段。但是,没有任何一种疫苗可以达到绝对的安全(就好像世上没有绝对的自由)。
由于疫苗的接种对象主要是健康人群,因此公众承担风险的能力较弱,人们对疫苗安全性的要求更高。很多时候,对一种事物的恐惧和不信任,很大程度上来源于“不了解”。因此,尽可能让大家理解疫苗的作用机制,尽可能公布疫苗接种的相关数据,让大家明白疫苗带来的获益远高于风险,是增强对免疫接种信心的重点。当然,对新型疫苗安全性的评估,我们还有很多问题需要时间去解答。总体来说,疫苗是绝大多数人的“天使”。
参考文献
[1]
[2]
[4] Fernando P Polack, Stephen J Thomas, Nicholas Kitchin, et al. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. N Engl J Med. 2020;383(27):2603-2615.
[5]
[7]
[8] 许涤沙,李克莉,武文娣,等. 中国2016疑似预防接种异常反应监测数据分析.中国疫苗和免疫.2018;24(3):299-322.
[9] McNeil MM, Weintraub ES, Duffy J, et al. Risk of anaphylaxis after vaccination in children and adults. J Allergy Clin Immunol 2016;137:868–78.
[10] Feng-Cai Zhu, Xu-Hua Guan, Yu-Hua Li, et al. Immunogenicity and safety of a recombinant adenovirus type-5-vectored COVID-19 vaccine in healthy adults aged 18 years or older: a randomised, double-blind, placebo-controlled, phase 2 trial. Lancet. 2020;396(10249):479-488.
[11] Zhiwei Wu, Yaling Hu, Miao Xu, et al. Safety, tolerability, and immunogenicity of an inactivated SARS-CoV-2 vaccine (CoronaVac) in healthy adults aged 60 years and older: a randomised, double-blind, placebo-controlled, phase 1/2 clinical trial. Lancet Infect Dis. 2021;S1473-3099(20)30987-7.
0
推荐




 京公网安备 11010502034662号
京公网安备 11010502034662号 