编辑 | 药明康德内容团队
今日,顶级学术期刊《细胞》在线发表了颜宁教授团队的最新论文。这项研究通过高分辨率冷冻电镜结构分析,揭示了两种药物联合使用时产生致命副作用的分子机制。这项突破为理解并避免相关药物互作的副作用奠定了重要基础。颜宁教授与现任职于武汉大学药学院的高帅教授为共同通讯作者。 2013年,一款名为索非布韦(sofosbuvir)的抗病毒药物诞生,成为人类攻克丙肝历程上的一座里程碑。作为首个无需干扰素就能高效治愈丙肝的直接抗病毒药物,索非布韦的出现彻底变革了丙肝的治疗,让患者不再受干扰素副作用的困扰。《细胞》杂志称其为“这一代人在公共卫生领域取得的最重要成就之一”。
2013年,一款名为索非布韦(sofosbuvir)的抗病毒药物诞生,成为人类攻克丙肝历程上的一座里程碑。作为首个无需干扰素就能高效治愈丙肝的直接抗病毒药物,索非布韦的出现彻底变革了丙肝的治疗,让患者不再受干扰素副作用的困扰。《细胞》杂志称其为“这一代人在公共卫生领域取得的最重要成就之一”。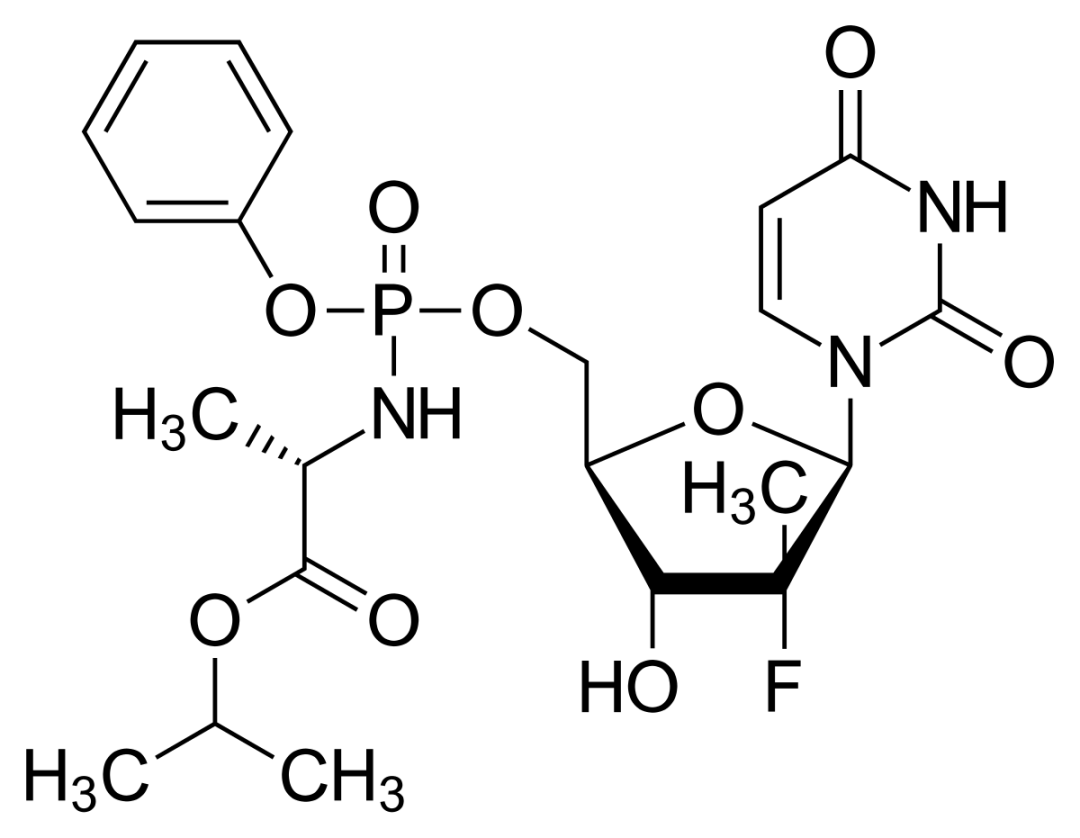
索非布韦的分子结构式丨图片来源:Yikrazuul [Public domain]
不过在临床应用中,索非布韦却遇到了意想不到的问题。2015年,美国FDA报告了患者在联合服用索非布韦和抗心律失常药物胺碘酮(amiodarone)后,出现严重心动过缓的案例。在9个此类病例中,有1例不幸死亡,3例需要安装起搏器治疗。由此人们意识到,索非布韦与胺碘酮联合使用可能导致致命的副作用。这种危险的药物相互作用是如何发生的?未来的药物设计又该如何避免? 对于这些问题,此前的研究已经有了一些初步发现。胺碘酮是一种作用于钙离子、钠离子和钾离子通道的多离子通道阻滞剂,而对于心肌炎患者,索非布韦或其类似物MNI-1会增强胺碘酮的钙运作效应,使得胺碘酮对L型钙离子通道(L-type Ca2+ channels,简称LTCC)的抑制作用变得更强,从而引起危险的心动过缓。不过,这个过程的具体分子机制尚不清楚,这也是颜宁教授团队探索的问题。
在了解最新研究之前,我们先来掌握钙离子通道的一些基本概念。电压门控钙离子通道(Cav)是钙离子进入细胞的重要通道,可以特异性传递钙离子,进而参与多种重要的生理过程。而Cav的功能异常或紊乱,可以导致神经、心血管系统等多种疾病。科学家们已经发现,包括人类在内,哺乳动物含有10个不同的Cav蛋白,根据序列的差别,它们可以分为Cav1、Cav2和Cav3三个亚家族,每个亚家族又包括了3~4个成员(例如Cav1包括Cav1.1- Cav1.4这4种通道)。前文介绍的与索非布韦、胺碘酮药物作用相关的LTCC,指的是其中的Cav1亚家族,同时也是高血压药物二氢吡啶的受体。解析Cav通道结构,正是颜宁教授团队多年来的重要研究方向之一。近年来,研究团队先后对Cav1.1、Cav3.1、Cav2.2等通道进行了高分辨率冷冻电镜结构分析,并为药物研发提供了洞见。例如,去年的一篇《自然》论文就揭示了强效止痛药齐考诺肽(ziconotide)与Cav2.2结合的结构,从而为创新止痛药的研发奠定结构基础。(相关阅读:祝贺!颜宁团队《自然》发文,揭示强效止痛药的作用机理)在最新研究中,颜宁教授团队对索非布韦/胺碘酮与Cav1通道结合的方式展开了深入研究。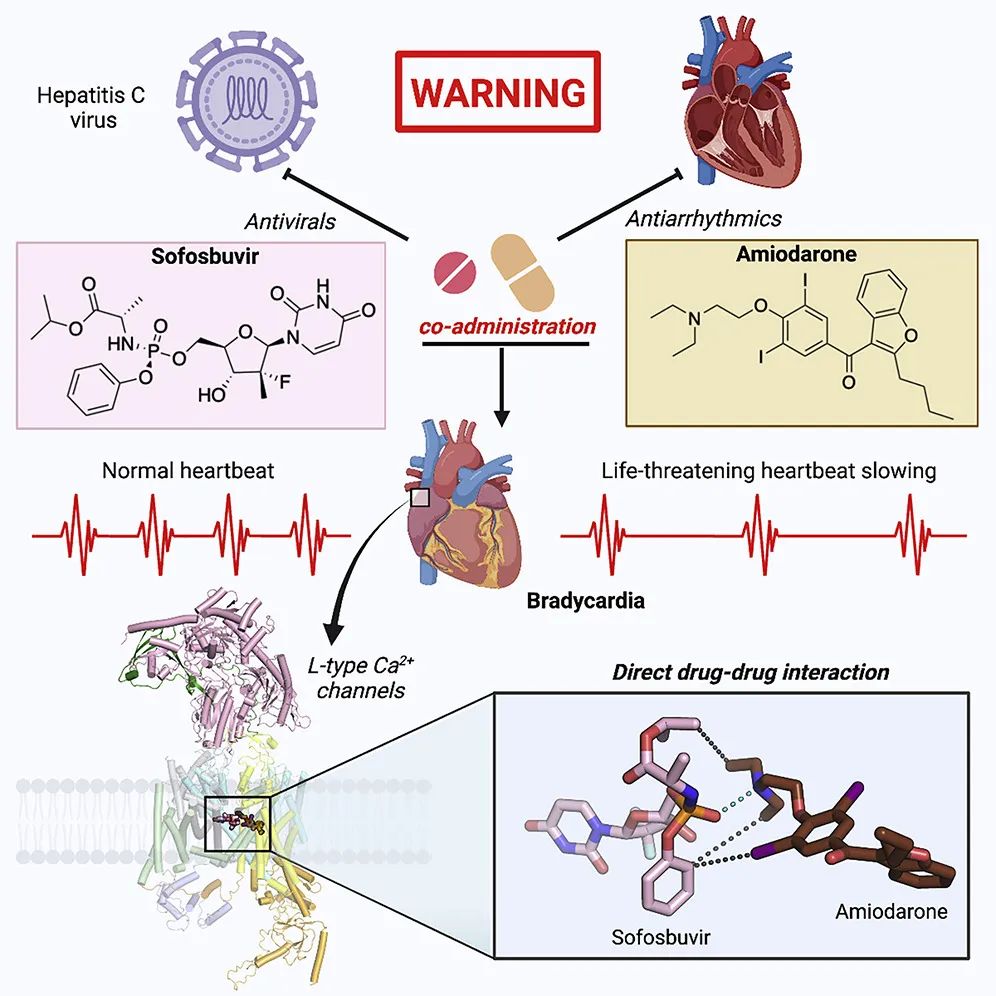 该研究示意图:研究团队破解了索非布韦、胺碘酮联合使用导致副作用的分子机制丨图片来源:参考资料[1]
该研究示意图:研究团队破解了索非布韦、胺碘酮联合使用导致副作用的分子机制丨图片来源:参考资料[1]
正如前文介绍,Cav1包括Cav1.1- Cav1.4这4个成员。其中,Cav1.1负责骨骼肌的兴奋与收缩;Cav1.2和Cav1.3的功能异常与心律失常相关:Cav1.2控制心肌细胞的兴奋与收缩, Cav1.3对于心脏的电生理活动必不可少;Cav1.4则是神经递质释放的关键通道。此前的研究也指出,索非布韦/ MNI-1与胺碘酮的联合使用会扰乱心肌细胞的钙运作,以及Cav1.2和Cav1.3通道的活动。考虑到这些钙离子通道在对于维持心脏功能的重要作用,在这项研究中,颜宁教授团队分析了在不同药物(或药物组合)的作用下,Cav1通道的结构信息。研究团队选择了两种Cav1通道作为研究对象,分别是兔源Cav1.1(常作为结构分析的原型)以及人源Cav1.3复合物。他们分别获取了索非布韦/MNI-1、胺碘酮单独作用,以及索非布韦、胺碘酮联合作用于Cav1.1和Cav1.3的高分辨率冷冻电镜结构。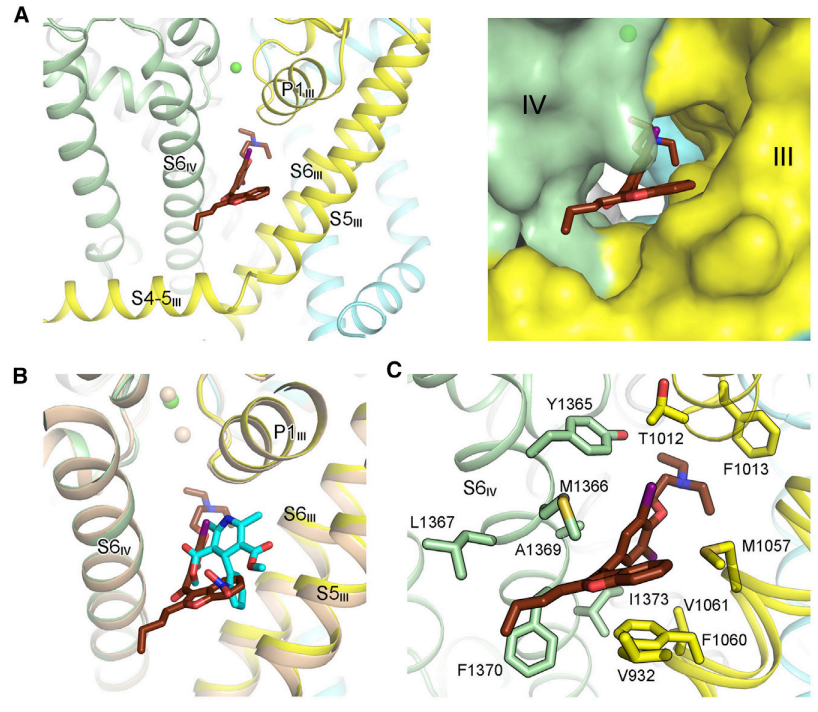
胺碘酮与Cav1.1结合的冷冻电镜图像丨图片来源:参考资料[1]
这项系统性分析发现了重要线索。首先,胺碘酮可以插入Cav1通道中重复序列III、IV之间的空腔,从而与Cav1结合。这个结构解释了胺碘酮是如何成为钙离子通道阻滞剂的。当索非布韦或MNI-1单独存在时,无论是面对Cav1.1还是Cav1.3通道,它们都无法与之结合;但当胺碘酮存在时,索非布韦/MNI-1可以与胺碘酮结合,并占据Cav1通道中心的空腔,从而直接阻断了通道中的离子穿透路径,使得Cav功能出现异常,直观体现就是心动过缓。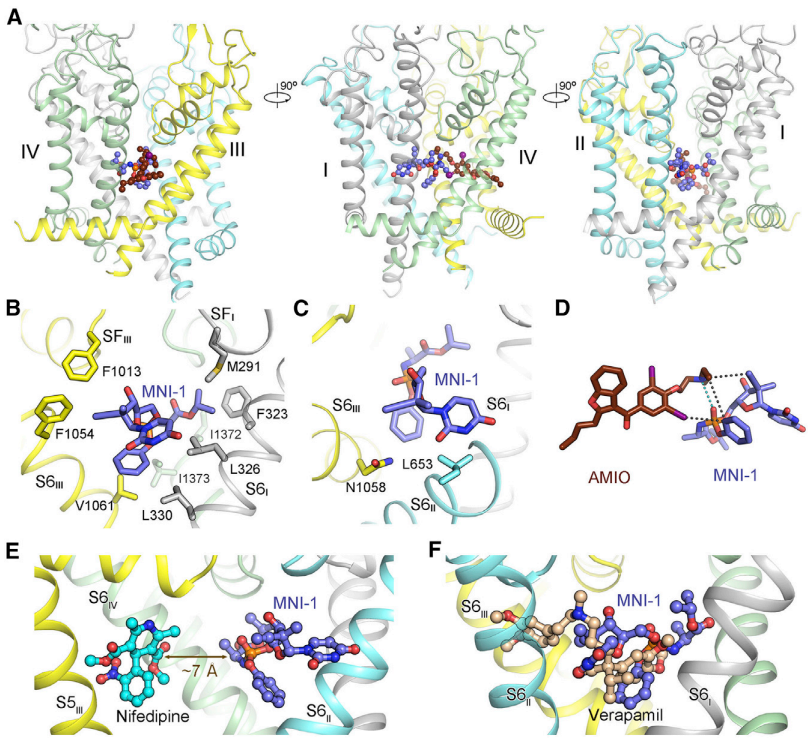
胺碘酮、索非布韦在Cav1.1上的药物相互作用丨图片来源:参考资料[1]
具体而言,以索非布韦/MNI-1、胺碘酮面对Cav1.1通道为例:Cav1.1的核心亚基包含4个重复序列(I-V),每个重复序列又包括6个跨膜区段(S1-S6)。MNI-1从S6II延伸至S6IV,穿越通道中心空腔并与所有4个S6螺旋接触。而胺碘酮帮助MNI-1与Cav1.1稳定结合的关键原因,一方面是疏水残基(主要位于S6区段)与复合物的疏水基团结合;另一方面是MNI-1的磷酸基团与胺碘酮的三级胺之间的极性相互作用。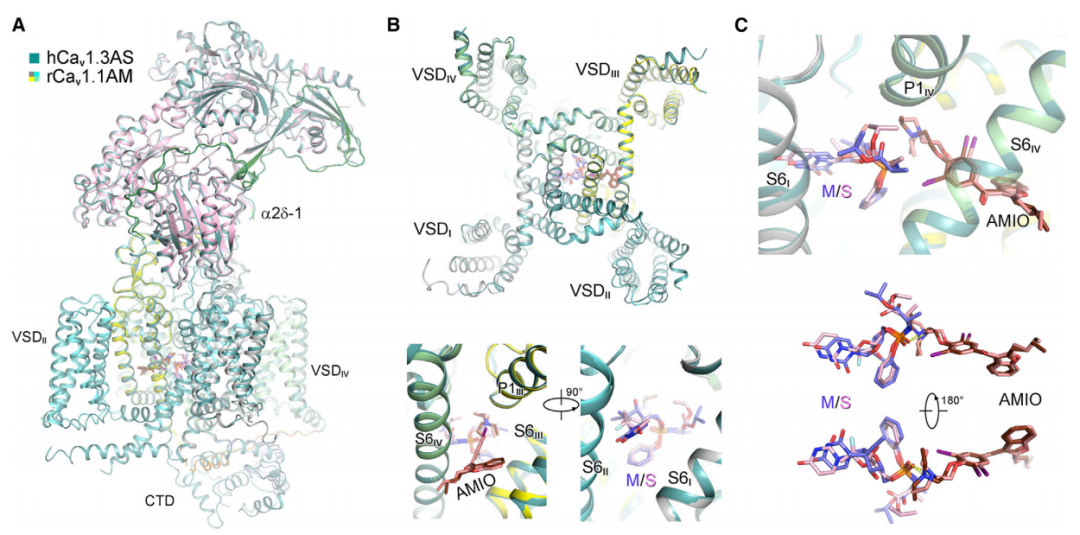 胺碘酮、索非布韦在人源Cav1.3上的相互作用丨图片来源:参考资料[1]
胺碘酮、索非布韦在人源Cav1.3上的相互作用丨图片来源:参考资料[1]
随后,研究团队还通过结构分析解释了,MNI-1为什么不会与另外两种常见心血管药物(硝苯地平和维拉帕米)产生类似的副作用。由此,这项研究直接揭示了两种小分子药物在钙离子通道上相互作用的物理与药物动力学机制,展现了结构生物学对于药物研发的作用,并为更安全的药物设计及联合用药策略提供了重要的结构指导。
参考文献
[1] X. Yao, S. Gao, et al., Structural basis for the severe adverse of sofosbuvir and amiodarone on L-type Cav channels. Cell (2022). DOI: 10.1016/j.cell.2022.10.024
本文经授权转载自微信公众号“学术经纬”,原题目为“刚刚,颜宁团队最新《细胞》论文上线!破解药物联合使用的致命副作用机制”。
0
推荐




 京公网安备 11010502034662号
京公网安备 11010502034662号 