人类离治愈癌症的目标,或许迈出了一大步,这次的主角是癌症疫苗。英国国家医疗服务体系正在启动一项大规模计划,要在全国招募数千名癌症患者,通过匹配将他们快速纳入到癌症疫苗的临床试验中。这是全球首个此类计划。目前的启动计划已经纳入了数十名癌症患者。
癌症疫苗以其极强的特异性,精准地靶向癌细胞,而不伤及“无辜”;它还会让患者的免疫系统牢记癌细胞的特征,有望为患者提供持久性的保护,防止癌症的复发。对患者来说,这是一个“里程碑时刻”。
撰文 | 木木
在全球范围内,癌症是人类最主要的致死原因之一,每年导致数百万人的死亡。尽管医学技术在不断进步,但是常见的癌症治疗方法,如手术、化疗和放疗仍然存在着诸多限制以及副作用。
近年来,一种旨在提供永久治愈癌症的创新技术,能够通过激发人体免疫系统来识别并攻击癌细胞,同时还能够防止癌症复发。这就是在癌症治疗领域被称为“改变游戏规则”的癌症疫苗。
近日,英国国家医疗服务体系(NHS)启动了一项开创性的个性化癌症疫苗临床研究,也被称为“matchmaking”计划,旨在为每位患者量身定制癌症疫苗。该疫苗仅需数周时间即可制备完成,通过引导患者自身的免疫系统来寻找、杀死癌细胞。
研究团队介绍,符合筛选标准并同意接受血液检测和癌症组织样本分析的患者,将有机会立即参与到这一全球首创的计划中来,而这也让很多患者看到了癌症治疗的一丝新曙光。
游戏规则改变者
癌症疫苗作为抗癌领域的一大突破性技术,旨在通过刺激人体自身的免疫系统,特别是T细胞来对抗癌细胞。
大家都知道,T细胞是免疫系统中负责识别和消灭异常细胞的关键免疫细胞。平时我们通过疫苗接种,就是激发和增强免疫细胞的功能,使其能够预防和治疗特定病原体。
癌症疫苗也是一样,可以分为预防性疫苗和治疗性疫苗。预防性疫苗旨在防止某些病毒感染引起的癌症,例如HPV疫苗用于预防宫颈癌;治疗性疫苗则针对已经发生的肿瘤,来帮助免疫系统识别和攻击癌细胞。
来源:Drug Target Review
但是与其他疾病的疫苗不同的是,癌症疫苗的一个重要目标是要克服肿瘤微环境(TME)中的免疫抑制。TME中存在大量的免疫抑制细胞和分子,如调节性T细胞(Tregs)、髓源性抑制细胞(MDSCs)和抑制性细胞因子(如TGF-β、IL-10),它们可以抑制免疫系统的抗肿瘤反应。
因此,通过接种癌症疫苗,可以增强效应性T细胞的活性,减少免疫抑制细胞的影响,改善TME,从而更有利于免疫系统攻击癌细胞。此外,癌症疫苗还能通过“抗原扩展”现象来增强免疫反应。所谓“抗原扩展”,即在初始疫苗接种后,免疫系统不仅会对目标抗原产生反应,还能识别和攻击其他肿瘤抗原,进一步扩大免疫反应的广度和强度。
与传统的化疗和放疗相比,癌症疫苗技术展现出了令人瞩目的优势。
一是其特异性极强,能够精准地靶向癌细胞,而不伤害周围的正常细胞,极大地减少了治疗的副作用;二是疫苗接种后,免疫系统会牢记癌细胞的特征,有望为患者提供更持久性的保护,并防止癌症的复发;再者,癌症疫苗能够实现个性化治疗,通过识别和针对每个患者特有的癌细胞突变,提供量身定做的治疗方案;此外,癌症疫苗还能与其他治疗方法协同作用,增强整体治疗效果,为患者带来更大的生存希望。
癌症疫苗不仅在延长患者生存期方面显示出巨大潜力,还可以显著改善患者的生活质量。与传统的化疗和放疗不同,癌症疫苗的副作用较少,患者在治疗过程中可以维持更好的生活质量。
因此,近年来随着研究的深入,癌症疫苗在诸多基础研究中已经展现了人类治愈癌症的一丝曙光。
肿瘤个性化疫苗试验计划
对于此次启动的大规模肿瘤个性化疫苗临床研究,NHS负责人阿曼达·普里查德认为,这对患者来说是一个“里程碑时刻”。
目前,NHS已招募数十名患者参与癌症疫苗启动计划,后续还计划在英格兰各地的30个NHS站点招募数千名患者。首批患者的试验将重点关注结直肠癌、皮肤癌、肺癌、膀胱癌、胰腺癌和肾癌,未来也会扩展到其他类型的癌症。
英国癌症研究中心研究与创新执行总监伊恩·福克斯表示,患者能够获得个性化疫苗接种“令人兴奋不已”,这一进展将成为抗癌斗争的“游戏规则改变者”。他强调:“像这样的临床试验对于帮助更多人活得更长、生活得更好、摆脱对癌症的恐惧至关重要。”
第一位加入癌症疫苗研究计划的NHS患者,名叫Elliot Pfebve。这位55岁的考文垂大学讲师一向身体很棒,但在一次接受全科医生的常规健康检查时,被诊断出患有结直肠癌。为此,他接受了肿瘤切除手术,切除了30厘米的大肠,并接受了化疗。随后,他在伯明翰大学医院NHS基金会接受了这种个性化癌症疫苗的接种。
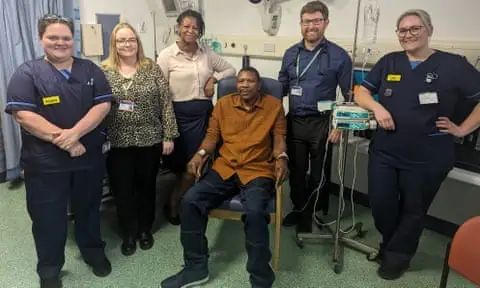
图:Elliot Pfebve(中)是第一位加入癌症疫苗计划的NHS患者丨来源:University Hospitals Birmingham NHS foundation trust
“参加这项试验是我一生中一个非常重要的决定,对我和我的家人来说都是如此。”Pfebve说道。“在经历了诊断的困难和令人虚弱的化疗之后,能够参与到一项可能带来新癌症治疗方法的试验中,我感觉很棒,如果其他人也能从试验的发现中受益,那将更好。”
一个有趣的点时,该疫苗的设计采用了与辉瑞/BioNTech开发新冠疫苗相同的mRNA疫苗技术。
在当今疫苗研发的前沿方向之中,DNA疫苗和RNA疫苗凭借其独特优势备受瞩目。
DNA疫苗技术通过引入编码特定肿瘤抗原的DNA序列到宿主细胞内,使细胞表达这些抗原,从而触发免疫反应。它的高稳定性、大规模生产的便利性以及编码多种抗原的能力,为肿瘤免疫治疗提供了新途径。然而,DNA疫苗的递送效率和表达水平仍有待提升。
RNA疫苗则利用mRNA分子在体内直接翻译成抗原蛋白,从而高效诱导免疫反应。RNA疫苗无需进入细胞核的特性也赋予了其高表达的效率,且生产工艺简单快捷,特别适合应对像肿瘤这种突变谱快速变化的疾病(类似于新冠病毒的快速突变)。然而,RNA的稳定性较低,因此需要借助脂质纳米颗粒等载体来保护和递送,以确保其有效性和安全性。
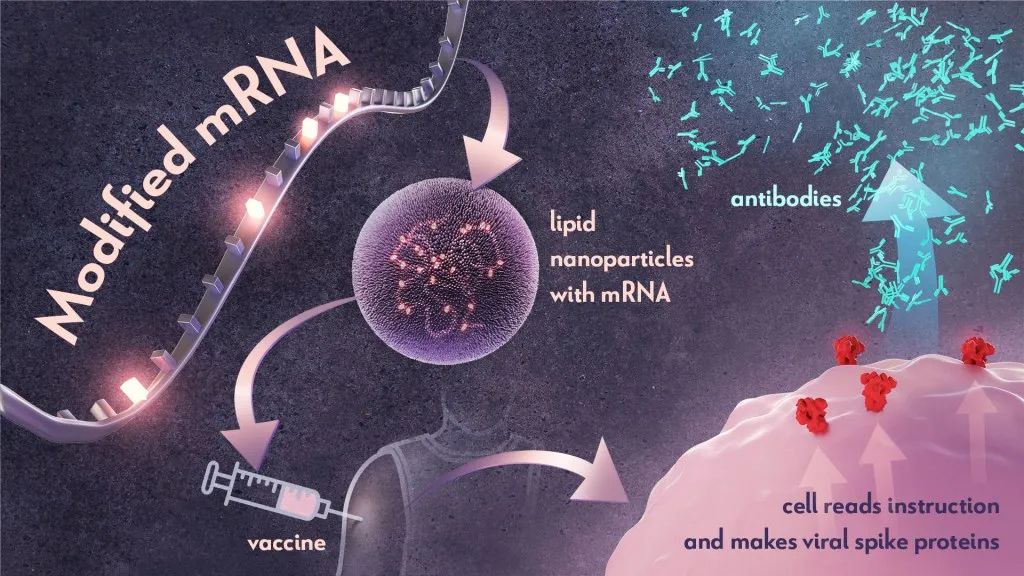
图:mRNA疫苗技术丨来源:Donny Bliss/NIH
在前沿疫苗研发领域,还有一种创新方式——合成长肽(SLP)疫苗。它使用合成的长肽,通过体内递送系统将其引入体内。这些长肽包含多个T细胞表位,能够同时激活CD4+和CD8+ T细胞,诱导强大的免疫反应。SLP疫苗的优势在于其高度特异性和可定制性,可以根据患者的肿瘤特异性突变设计。然而,SLP疫苗的生产成本较高,并且也需要精确的递送系统来确保有效性。
挑战与新进展
尽管癌症疫苗在肿瘤治疗领域展现出巨大的潜力,但其开发和应用过程仍然充满了许多复杂且艰巨的挑战。这些挑战不仅涉及到如何选择合适的抗原,还包括应对肿瘤细胞的免疫逃逸机制、改良肿瘤微环境以及优化疫苗递送平台等多个方面。
尽管面临这些挑战,癌症疫苗领域仍在快速发展。随着科学技术的不断进步,尤其是新技术、新工具的出现,许多挑战和难题正在一点点被攻破。
比如随着下一代测序技术的快速发展,通过测序患者的肿瘤DNA和RNA,可以快速准确地识别患者的肿瘤基因突变,进而设计相应的疫苗。治疗性癌症疫苗的成功很大程度上取决于疫苗中抗原的性质,尤其是发现更多的潜在新抗原。新抗原是由于肿瘤基因突变产生的蛋白质片段,与正常细胞中表达的蛋白质不同,因此免疫系统可以将其识别为外来物质。
再比如,新型递送平台的不断进步,尤其是新型纳米颗粒和自组装微粒的开发,为癌症疫苗提供了更有效的递送手段。新型递送平台是疫苗平台发展中的重要组成部分,传统的疫苗递送方式可能无法有效地将疫苗成分递送到目标部位,如淋巴结或肿瘤微环境。而新型递送平台,是比细胞更小的非细胞颗粒,通常称为“纳米颗粒”(大小范围为20-100纳米)。科学家正在探索用它们当载体,来改善非细胞蛋白或肽基治疗性癌症疫苗平台。此类方法包括脂质体递送、两亲性(Amph)疫苗、脂质体和新型自组装纳米颗粒(由TLR7/8-SLP新抗原结合物(SNP-7/8a)组成)。此外,聚乙烯亚胺硅微棒(MSR)疫苗也被证明可以增强HPV-16 E7和多个新抗原肽的免疫原性,在小鼠中治疗既存肿瘤时效果显著。
此外,近年来计算生物学和生物信息学的发展,也使得个性化癌症疫苗的设计变得更加可行。癌症是高度异质性的疾病,不同患者的肿瘤具有不同的突变谱和免疫特征,因此个性化癌症疫苗的思路就是根据每个患者的具体情况设计特定的抗原和治疗方案。而这种个性化的解决方案,显然更需要生物信息技术的强大支撑。
总的来说,治疗性癌症疫苗在过去几十年中取得了显著发展。尽管面临许多挑战,但随着对肿瘤免疫机制的深入理解和新技术的发展,疫苗设计和递送平台得到改进,通过优化抗原选择、增强免疫反应、克服免疫逃逸机制以及探索组合治疗策略,治疗性癌症疫苗有望在未来成为癌症治疗的重要组成部分。
而且,癌症疫苗的研究和发展也促进了我们对免疫系统和癌症生物学的理解。通过研究癌症疫苗如何工作,科学家们能够深入了解免疫系统如何识别和攻击癌细胞,以及肿瘤如何逃避免疫监视。这些知识不仅有助于开发更有效的癌症疫苗,还可以应用于其他类型的免疫治疗。
我们有理由相信,随着研究的不断深入,癌症疫苗将成为抗击癌症的重要武器,为人类战胜这一重大疾病带来曙光。
参考资料
[1]
[2]
[3]Wang SS, Liu W, Ly D, Xu H, Qu L, Zhang L. Tumor-infiltrating B cells: their role and application in anti-tumor immunity in lung cancer. Cell Mol Immunol. 2019;16(1):6-18. doi:10.1038/s41423-018-0027-x
[4]Mollica Poeta V, Massara M, Capucetti A, Bonecchi R. Chemokines and Chemokine Receptors: New Targets for Cancer Immunotherapy. Front Immunol. 2019;10:379. Published 2019 Mar 6. doi:10.3389/fimmu.2019.00379
[5]Balan S, Radford KJ, Bhardwaj N. Unexplored horizons of cDC1 in immunity and tolerance. Adv Immunol. 2020;148:49-91. doi:10.1016/bs.ai.2020.10.002
[6]Ruhland MK, Roberts EW, Cai E, et al. Visualizing Synaptic Transfer of Tumor Antigens among Dendritic Cells. Cancer Cell. 2020;37(6):786-799.e5. doi:10.1016/j.ccell.2020.05.002
[7]Roberts EW, Broz ML, Binnewies M, et al. Critical Role for CD103(+)/CD141(+) Dendritic Cells Bearing CCR7 for Tumor Antigen Trafficking and Priming of T Cell Immunity in Melanoma. Cancer Cell. 2016;30(2):324-336. doi:10.1016/j.ccell.2016.06.003
[8]Ott PA, Hu Z, Keskin DB, et al. An immunogenic personal neoantigen vaccine for patients with melanoma [published correction appears in Nature. 2018 Mar 14;555(7696):402]. Nature. 2017;547(7662):217-221. doi:10.1038/nature22991
[9]Appay V, Jandus C, Voelter V, et al. New generation vaccine induces effective melanoma-specific CD8+ T cells in the circulation but not in the tumor site. J Immunol. 2006;177(3):1670-1678. doi:10.4049/jimmunol.177.3.1670
出品:科普中国
0
推荐




 京公网安备 11010502034662号
京公网安备 11010502034662号 