阅读:0
听报道
近日,西湖大学周强实验室利用冷冻电镜技术成功解析此次新冠病毒的受体——ACE2的全长结构。这是世界上首次解析出ACE2的全长结构。相关研究内容于北京时间2月19日凌晨3点左右在预印版平台bioRxiv上线,文章题为“Structure of dimeric full-length human ACE2 in complex with B0AT1”。据悉,bioRxiv最近一段时间收到大量有关新冠病毒的研究论文投稿,为避免误导读者,相关论文都要经过二次审核,所以从投稿到上线所需时间比其他论文要延迟一到数日。
新型冠状病毒感染引发的肺炎疫情暴发后,武汉病毒研究所的科学家发现,新型冠状病毒和2003年的SARS病毒一样,也是通过识别ACE2蛋白进入人体细胞的,ACE2是“新冠病毒”侵入人体的关键。研究发现,在SARS病毒和“新冠病毒”侵入人体的过程中,ACE2就像是“门把手”,病毒抓住它,从而打开了进入细胞的大门。
此前,曾有研究解析出ACE2的一个胞外结构域与SARS病毒S蛋白形成的复合物的三维结构。最近美国得克萨斯大学奥斯汀分校的研究团队又展示了新冠病毒的S蛋白结构。然而,ACE2到底在细胞膜上是以什么状态存在?新冠病毒对比SARS病毒与ACE2结合有何异同?获取ACE2的全长蛋白及其与S蛋白的复合物结构,将大大有助于解答上述疑问。
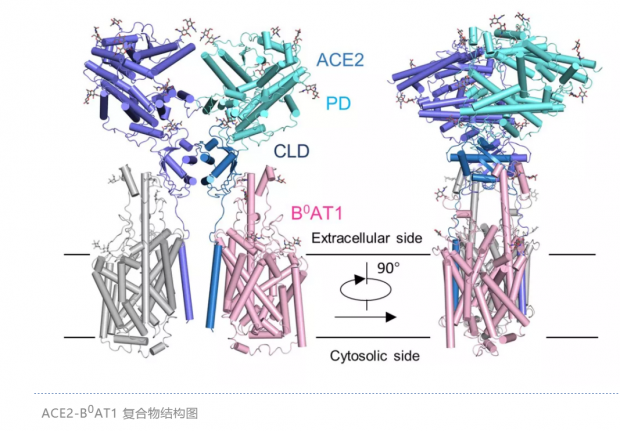

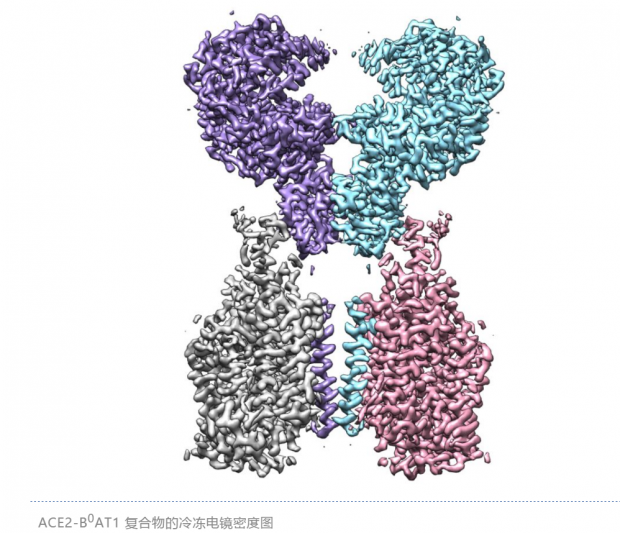
周强实验室针对这个问题进行了攻坚。第一步,他们要获取ACE2蛋白全长蛋白,但作为膜蛋白的ACE2本身很难在体外稳定获得。周强及博士后鄢仁鸿在文献中发现ACE2与肠道内的一个氨基酸转运蛋白B0AT1能够形成复合物。根据他们过去的研究经验,这个复合物极有可能稳定住ACE2。果然,他们通过共表达的方法获得了ACE2与B0AT1优质稳定的复合物,并利用西湖大学的冷冻电镜平台成功解析了其三维结构,分辨率达到2.9埃,对于病毒识别至关重要的胞外结构域分辨率为2.7埃。
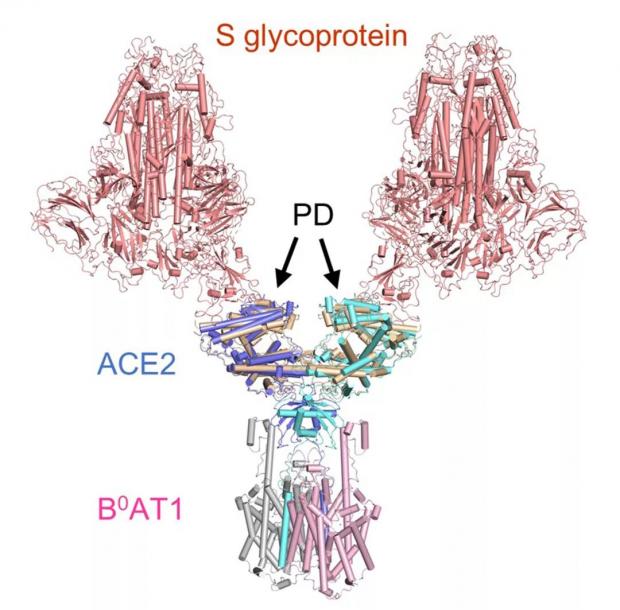
ACE2-B0AT1 复合物和之前解析复合物(SARS-CoV的S蛋白与ACE2的PD结构域的复合物)的比较,两种复合物通过PD结构域锚定在一起。
通过分析ACE2的全长蛋白结构,周强实验室发现ACE2以二聚体形式存在,同时具有开放和关闭两种构象变化,但两种构象均含有与冠状病毒的相互识别界面。
这一研究发现为进一步解析全长ACE2和新冠病毒的S蛋白复合物的三维结构奠定了基础。而这个工作本身为理解新冠病毒侵染细胞提供了很多有趣的线索。
比如,ACE2的二聚体与新冠病毒S蛋白的三聚体是否可以发生更高层级的交联,从而促进病毒与宿主细胞膜的融合或者内吞?之前有研究表明ACE2的胞外区如果被切割,将会更有效地促进冠状病毒的侵染,但是ACE2与B0AT1的复合物结构显示B0AT1的存在有可能阻碍蛋白酶靠近这个切割位点,这是否解释了为什么病毒侵染症状主要发生在没有B0AT1的肺部?
这一系列通过结构研究揭示的问题有待未来多学科探索。
总体而言,“ACE2全长结构的解析,将有助于理解冠状病毒进入靶细胞的结构基础和功能特征,对发现和优化阻断进入细胞的抑制剂有重要作用”,清华大学全球健康与传染病研究中心主任张林琦教授说。

什么是“结构生物学”?
所谓“眼见为实”,结构生物学将构成我们身体、支持我们生命活动的生物大分子(蛋白质、核酸)从结构角度揭示出来,搞清楚它们如何正常工作,而它们的异常又是如何导致病变的。该领域的研究不仅可以解决一系列生命领域重大基础科学问题,还可以帮助科学家根据疾病相关分子的特殊结构设计药物,不断提高人类的生活质量。
本文经授权转载自微信公众号“西湖大学Westlake University”。
话题:
0
推荐
财新博客版权声明:财新博客所发布文章及图片之版权属博主本人及/或相关权利人所有,未经博主及/或相关权利人单独授权,任何网站、平面媒体不得予以转载。财新网对相关媒体的网站信息内容转载授权并不包括财新博客的文章及图片。博客文章均为作者个人观点,不代表财新网的立场和观点。




 京公网安备 11010502034662号
京公网安备 11010502034662号 