
来源:dreamstudio
撰文 | Allison Whitten
译者 | M. W.
校对 | 光影
要想观察人类神经元的发育、连接及相互作用的过程,我们仍面临许多现实的、伦理上的难题,而科学家们对人脑内部运转方式的认识长期以来都受困于此。但最近,于《自然》发表的一项新研究中,由塞尔久·帕斯卡(Sergiu Paşca)带领的一众斯坦福大学神经科学家[1],报告了他们发现的一种研究人类神经元的新方法——在大鼠大脑还没有完全发育成熟时,将人类类脑组织移植到这些刚出生几天的大鼠中。研究者发现,人类的神经元及其他脑细胞能够正常发育并与大鼠的大脑融合,最终成为功能性神经环路的一部分,并能参与感觉处理与一些行为的控制。
有了这项技术,科学家们就能为一系列的神经发育障碍(包括某些形式的孤独症谱系障碍)建立新的活体模型了。对神经科学实验室中进行的研究来说,这些模型就和现有的动物模型一样实用,但由于这些新模型在功能性神经环路中包含了真正的人类细胞,相比之下它们是研究人类疾病更好的替代。一些现代神经科学工具因为侵入性不适用于真正的人脑,不过现在,这种新模型给了它们用武之地。英国剑桥分子生物学实验室(MRC Laboratory of Molecular Biology)的神经科学家玛德琳·兰开斯特(Madeline Lancaster)虽没有参与该研究[2],却说道:“这个方法对该领域来说是向前迈出的一大步,它提供了一种理解神经元功能障碍的新途径。”这项工作也开启了类脑器官使用的新篇章。
近15年前,生物学家发现人类干细胞能够自组织,并且形成囊括不同细胞种类、类似脑组织的小球。之后,这些类器官便为研究脑细胞活动打开了新窗口,但我们从这个窗口中看到的景象十分有限。虽然培养皿中的神经元能够和彼此连接并通过电信号交流,它们却不能形成真正的功能性神经环路,也不能像在它们自然情况下的栖息地——大脑中那样得到充分发育或实现计算水平上的超凡能力。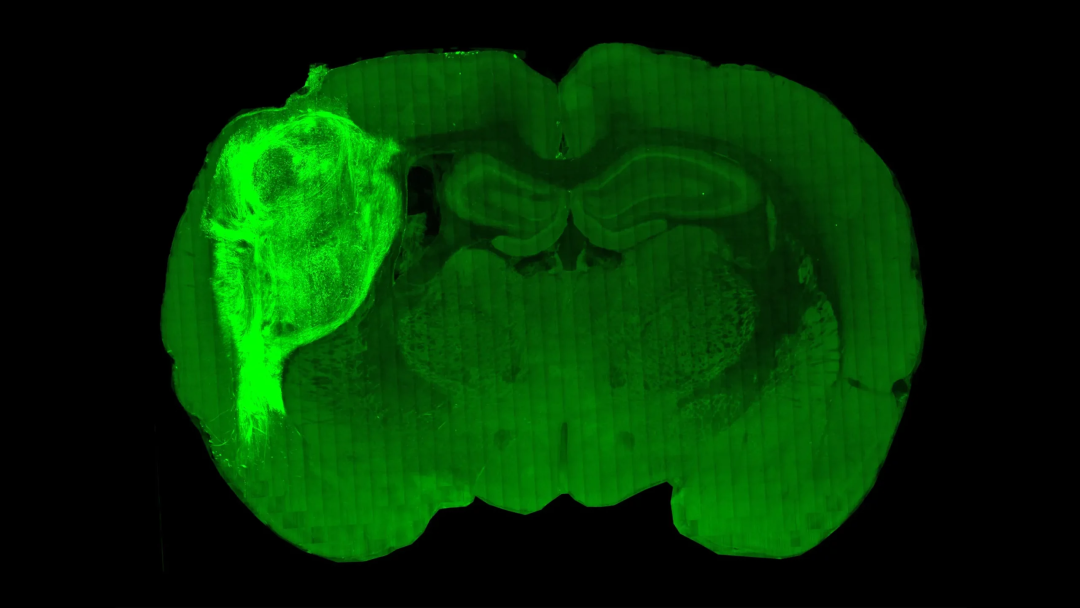
实验室大鼠大脑的横截面图中,移植到其中的人类类脑器官(左侧亮区)得以大规模生长。新研究显示,人类组织不仅可以在其中生长,还能与大鼠大脑的神经元形成真正的连接。丨斯坦福大学帕斯卡实验室
多年前,一些研究团队的创举证明了人类大脑类器官可以移植到成年大鼠的大脑中并成功存活[3]。但上述的新研究第一次表明,正在发育的新生大鼠大脑能够接受人类的神经元并任其发育成熟,还能将这些人类神经元整合进能够驱动大鼠行为的局部神经环路。帕斯卡指出,考虑到人和大鼠的神经系统发育的方式及时机之间存在巨大的差异,“我们有成千上万个理由认为这项工作不会成功。”但实际上它成功了,人类细胞最终接收到了和其他细胞做出关键连接所需的指示信号。
南加州大学的神经科学家乔吉娅·瓜德拉托(Giorgia Quadrato)说[4]:“这是一项十分有必要且完成得非常漂亮的研究,它带领整个领域驶向正确的方向——我们寻找的方法要能提高生理上(和真正人脑的)关联性,来让人类类脑器官模拟人类大脑发育后期出现的状况。”
理解神经元中偏离正轨、导致脑部疾病的细胞及分子过程,是帕斯卡一直以来的动力来源[5]。众多精神及神经障碍都始于神经发育的过程(虽然很多症状在多年以后才会显现),因此,填补我们这部分知识空白的最好方式,就是切实地观察神经元如何发育。这就是为什么自从帕斯卡十三年前开始研究神经元起,他就一直致力于将人类大脑类器官移植到新生大鼠中。
在帕斯卡和他在斯坦福大学的同事菲丽希缇·戈尔(Felicity Gore)[6]、凯文·凯利(Kevin Kelly)[7]和奥马尔·雷瓦(Omer Revah,现就职于希伯来大学)的带领下,研究团队在幼年大鼠的神经环路完全形成之前,将人类大脑皮层类器官插入到幼年大鼠的躯体感觉皮层中。这样,人类神经元就能与这一处理外界传入的感觉信息的关键脑区形成长期连接。至于之后类器官能否与大鼠发育中的大脑的其他部分声气相投,研究人员只能等待。
视频中,闪光代表钙离子在移植的类脑器官里人类神经元中的流动。这些人类神经元对所处的大鼠大脑发来的信号作出自发的放电反应。
帕斯卡说:“我们发现,如果我们在这么早的阶段就把类脑放进大鼠大脑里……它在四或五个月里就能长到原来的九倍大。”然后这块类人脑组织的区域就占据了大鼠大脑一个半球的三分之一。
但是,即便人类神经元依然集体驻扎在当初研究人员通过手术将它们放置的区域,研究人员却表示,这些神经元后来变成了鼠脑神经环路活跃的一部分,而这些环路深深交织在鼠脑内部。大部分移植的人类神经元开始对大鼠胡须传来的触觉作出反应:当研究人员向胡须喷气,那些人类神经元的电活动就变得更加活跃。
更令人震惊的是,神经信号还能以相反方向流动并影响大鼠行为。研究人员(通过一种名为光遗传的技术)用蓝光刺激人类神经元后,触发了大鼠的条件反射,这让他们更频繁地舔舐水瓶来寻求奖励。
帕斯卡说:“这意味着我们真的把人类神经元融合进大鼠的神经环路了。这不单是环路的改变……而是说,人类细胞现在是环路的一部分了。”
不过,移植的细胞在它们的新家里并没有完全模拟人类脑组织。例如,它们没有像在人的大脑皮层里时那样自动形成多层结构。(它们也没有听从周围大鼠神经元的指令、获得大鼠躯体感觉皮层的水桶状细胞簇的特征。)但是移植的神经元保留了很多真正人类神经元的电学及结构特征。
塞尔久·帕斯卡,斯坦福大学精神病学及行为科学教授、吴蔡神经科学研究院(Wu Tsai Neurosciences Institute)斯坦福脑器官发生项目(Stanford Brain Organogenesis Program)负责人。丨瑞秋·布加尔斯基(Rachel Bujalski)为Quanta Magazine供图
对于细胞来说,能真正处在大脑(而不是培养皿)里的一个主要优势是,它们能成功与大鼠大脑的血管系统相连,从而让血管散布整个类脑组织并传输氧气和激素——移植的细胞正是利用了这点好处。帕斯卡解释道,血液供给的缺乏被认为是培养皿中的人类神经元往往不能完全发育成熟的主要原因;当然,神经发育的塑造或许也需要神经信号的输入,而这在培养皿中同样难以实现。移植的神经元和在培养皿中生长的人类神经元相比,前者比后者大出六倍——前者的尺寸和电活动情况都更接近自然状况下人类脑组织里的神经元。
帕斯卡说:“活体环境中的一些因素,也就是细胞在大脑中接收到的养分和电信号将它们推向了更成熟的水平。”正因为人类神经元在大鼠大脑中能够达到如此成熟的状态,在用蒂莫西综合症(Timothy Syndrome,一种遗传病,也叫长QT综合症,常伴随孤独症及癫痫)患者的干细胞培养的类脑器官中,帕斯卡和同事才能看到一些不寻常的神经发育上的不同。在大鼠大脑中,这些移植的、携带蒂莫西综合症基因的人类神经元长出了异常的树突分支,从而与其他细胞形成了不寻常的连接。关键是,一些像这样的非典型发育只能在大鼠皮层里的人类神经元里观测到,培养皿中的类器官神经元则没有这种迹象。
帕斯卡强调,一直以来,我们都看不到在这些逐渐成熟的神经元中发生的细微改变,而这些改变却能影响大脑功能并导致神经及精神障碍。加州大学洛杉矶分校的神经科学家、干细胞生物学家本尼特·诺维奇(Bennett Novitch)说道[8]:“这些结果非常令人激动。”他提示道,对于各种神经疾病的研究和药物测试来说,神经组织的体外研究仍将会是更快且更实用的方法,但是这篇新发表的论文“阐释了为什么活体环境仍然是……探究人类神经元成熟的特征的最佳条件。”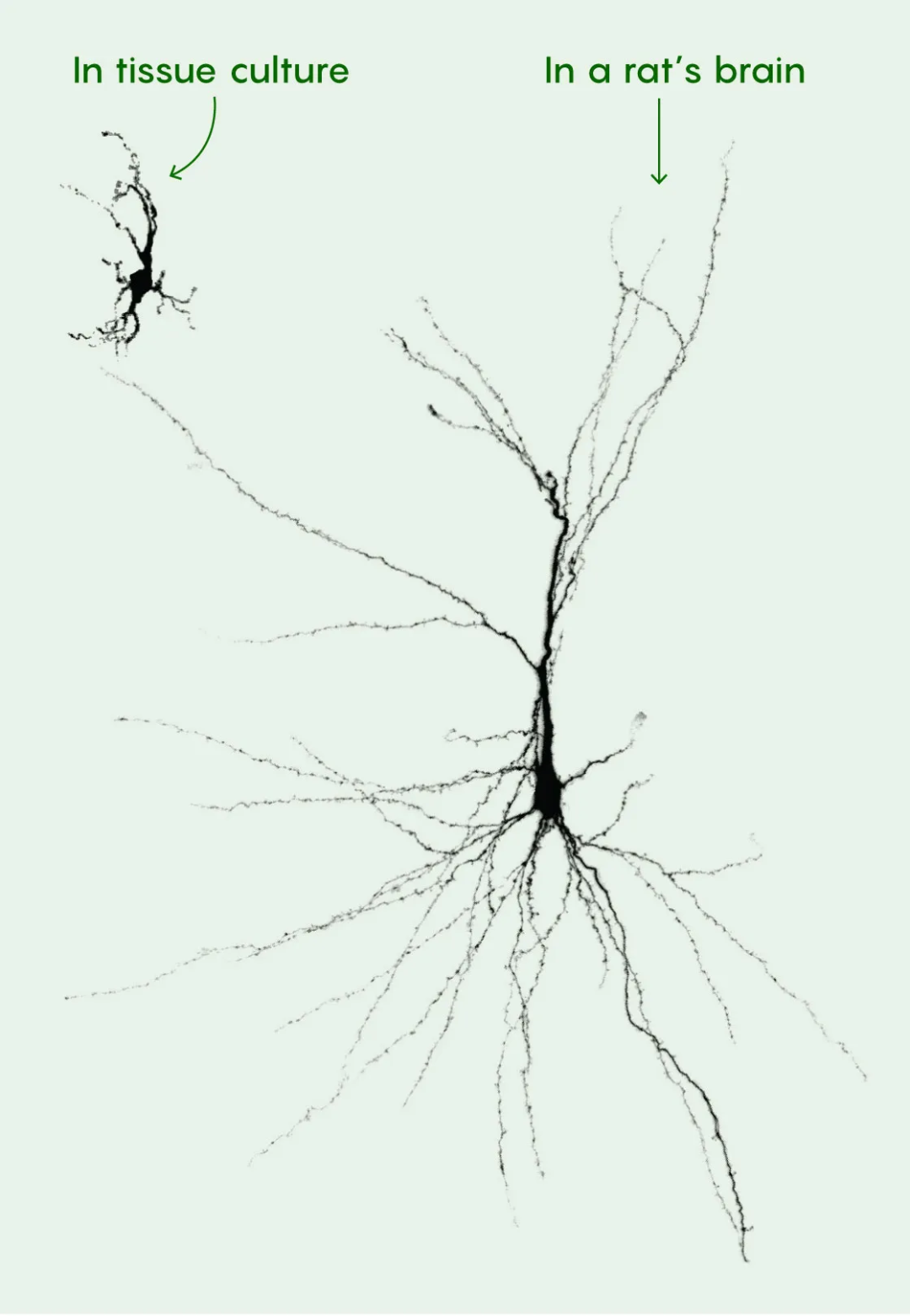
大鼠大脑中移植的神经元(右侧)的尺寸和复杂性是在培养皿中的类脑器官里生长的人类神经元(左上角)的数倍。丨斯坦福大学帕斯卡实验室
帕斯卡希望这一突破最终能让我们向治疗精神障碍及神经系统疾病的未来更近一步。该领域的其他学者也对此抱有很大希望。西奈山伊坎医学院(Icahn School of Medicine at Mount Sinai)的神经科学家乔尔·布兰查德(Joel Blanchard)[9]说:“如果类器官移植的策略能真正模仿疾病的特征,它将大大加速我们通往治愈这些疾病的进程。”这项研究的性质也激起了关于实验动物福利及善待的一些问题。因此,帕斯卡和同事从一开始就与伦理学家开展了积极的讨论。在所有包含动物的实验中,都有一条法律规定大鼠必须由实验室技术员严格监测,并且技术员有权在任何时候停止实验。不过,在该研究中,移植了人类类脑器官的大鼠并没有在行为及认知测试环节展现出任何异常。
哈佛医学院生物伦理学中心(Center for Bioethics)的生物伦理学家尹素秀(Insoo Hyun)说[10],他对当前的实验没有任何伦理上的顾虑。国际干细胞研究协会(International Society for Stem Cell Research)建立了指导方针来监管人类类脑器官及人类细胞在动物中的移植,而帕斯卡的团队遵循了所有规定。尹素秀说:“对我来说,真正的问题是要意识到‘该领域在这项研究之后会通向何方?’”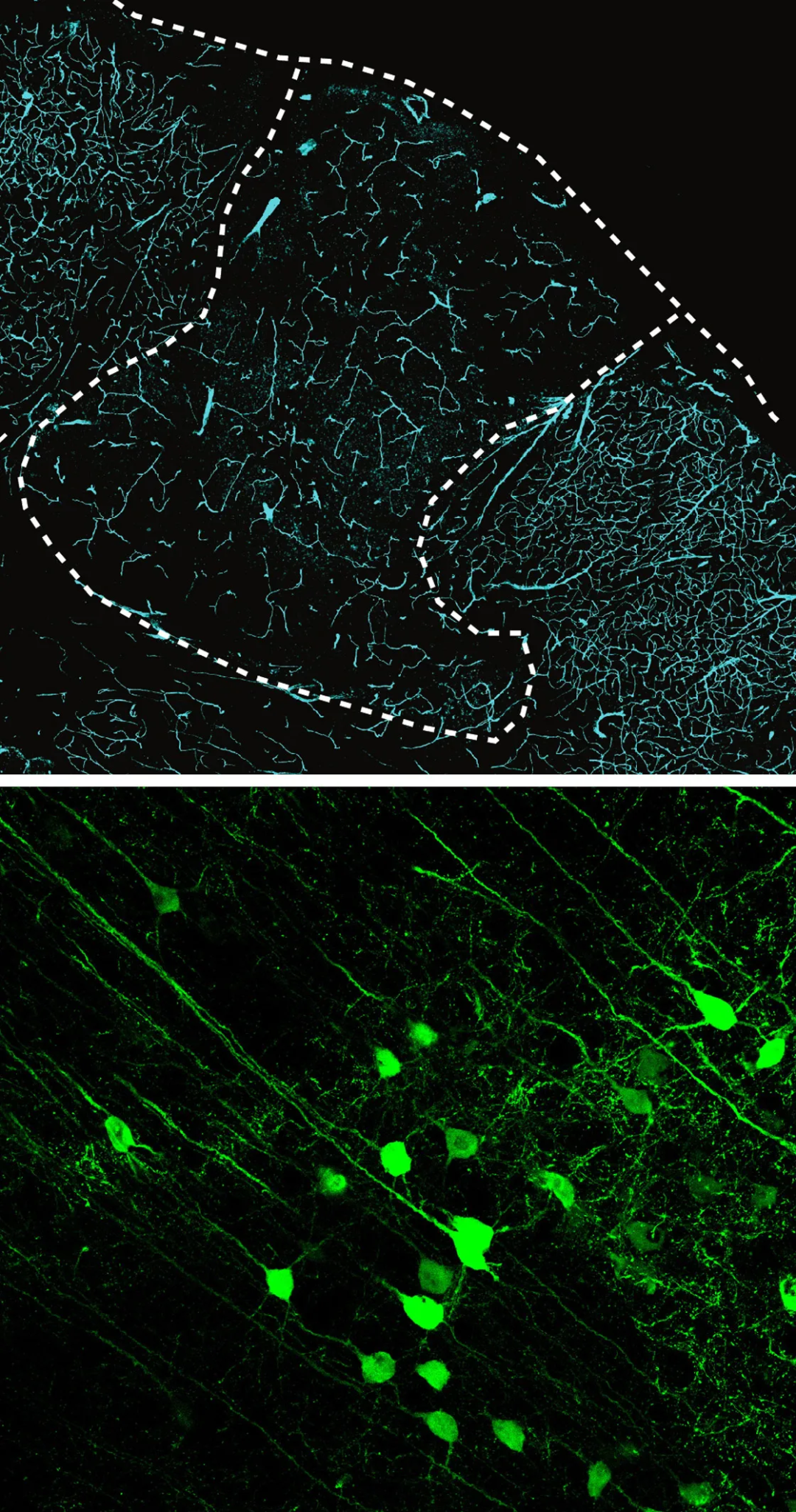
帕斯卡的实验大鼠之一的皮层横截面(上图)。虚线标记了移植的人类类脑器官的边缘。染色剂显示,大鼠的血管高度血管化了移植的类器官。在另一项实验中,距植入的类器官较远的大鼠神经元发出绿光(下图),这意味着它们已经与人类细胞形成了有效的突触。丨斯坦福大学帕斯卡实验室
尹素秀更担心的是,可能会有团队受到启发想要将人类类脑器官移植到与我们更为相近的物种(例如非人灵长类)中。他说:“从监管层面,我们必然会展开激烈的讨论,来论证为什么我们要推进到这种更复杂的情况。”帕斯卡说他和他的同事对这种突破界限的实验并没有兴趣。他还认为,在移植过程中培养和维系类器官的难度也会限制大部分这类轻率的研究。他说:“几乎没有实验室能保证设备和专业人才都足以支持这种实验。”
如何改进移植到大鼠的人类类脑器官才是更迫在眉睫且更切实的科学挑战。无疑,我们还有漫漫长路要走。目前,人类类脑组织不仅遗漏了参与抑制其他神经元活动的神经元,还缺少很多神经元之外的脑细胞,例如小胶质细胞和星型胶质细胞。帕斯卡的团队因此正致力于“装配体”(assembloids,代表不同脑区的类器官能通过细胞迁徙和相互作用组合到一起形成装配体)的移植实验。
或许,我们在大鼠大脑中的人类神经元得到的发现在自然人脑中的应用是有限的。这些移植研究中使用的大鼠由于基因突变生来就有免疫系统缺陷。正由于它们的免疫系统不太可能排斥植入的人类细胞,它们才如此适用于移植。但这也意味着研究阿尔兹海默病等已知与免疫有关的神经退行性疾病可能更加困难。并且无论移植的人类大脑类器官有多么真实,只要它们还在大鼠大脑里,它们接触的就是有着独特的养分和激素构成的大鼠血液,而非人类血液。因此,某种程度上,神经科学家将来研究的这种系统可能与人类头骨里的现实有些差距。
不同寻常的神经生物学过程如何导致了神经及精神障碍呢?对于帕斯卡来说,这个新系统至少提供了一个机会,让我们比以往任何时候都更接近这个问题的真相。终于,通过将类器官移植到新生的大鼠中,我们在人类神经元及神经环路的发育研究方面,开拓出了一片能全力发挥现代神经科学工具力量的疆土。
帕斯卡说:“理解那些人类独有的情况——例如精神疾病——无疑是个难题。难题就需由大胆的举措来破解。”
参考文献
[1]
[2] https://www2.mrc-[3] [4] [5] [6] [7] [8] [9] 、
M. W.:神经科学本科在读,热衷于杂糅和想象。
光影:神经现实编辑。业余认知科学&动画爱好者。愿与智者同行,于学海沉钩,一切不过慢慢赶。
本文经授权转载自微信公众号“神经现实”,编辑:M. W.。
原文:
0
推荐




 京公网安备 11010502034662号
京公网安备 11010502034662号 