一氧化氮(NO)曾普遍被视为一种有毒有害气体,应尽可能远离。然而,后来的科学研究揭示它在生物体内发挥极为重要的生理作用,NO是首个被发现在动物体内起到气体信号分子作用的物质。这项开创性的工作是由美国药理学家斐里德·穆拉德通过实验阐明的,最初他意外发现了含氮物质能够激活特定的酶,进而揭开了硝酸甘油治疗心绞痛的机理——即一氧化氮分子介导的信号转导能够促使平滑肌舒张;同时进一步证实了内源性NO的存在。本文将主要介绍穆拉德的科研历程,展示他如何逐步取得这项重大发现,见证科学与生命的奇妙邂逅。
撰文 | 郭晓强(河北体育学院)
提到一氧化氮(Nitric oxide,NO),大家第一印象是一种有毒气体和环境污染物,事实也的确如此,但这种看法忽视了它在人体中的重要作用。
NO无色无味,于1779年由英国著名化学家约瑟夫·普利斯特里(Joseph Priestley)首先发现,他还发现一氧化二氮、二氧化氮、氧气、氨气、氯化氢等众多气体。后续研究中,NO都被看作大气污染物,是烟草、柴油和汽油等燃烧副产品,经机动车排放、工业排放和微生物释放等过程产生。毒理学实验显示,吸入一定量NO(具体数值可能因条件和个体差异而异)可导致轻度呼吸急促和咳嗽,一段时间后出现支气管痉挛和肺水肿;吸入高浓度NO会造成烧伤、痉挛、喉咙组织肿胀、上呼吸道阻塞甚至死亡。工作场所NO浓度允许上限为8小时内25ppm(part per million,百万分之一),当达到100ppm时对生命和健康造成严重危险。
直到20世纪70年代,美国药理学家斐里德·穆拉德(Ferid Murad)首先揭示了其有益的一面,并进一步发现它在体内还发挥着至关重要的生理功能,NO这个“百害而无一利”的标签才被去除。穆拉德也因此与他人共享了1998年的诺贝尔生理学或医学奖。

斐里德·穆拉德(Ferid Murad,1936.9.14—2023.9.4)
一
志存高远
1936年9月14日,穆拉德出生于美国印第安纳州怀廷市一个移民家庭。父亲来自阿尔巴尼亚,以经营小杂货店为生,因此经济条件有限,全家五口挤在一个不满50平米的小房间。父母辛苦劳作维持生计,每日工作很长时间,这为穆拉德带来很大影响,他从小就下定决心努力学习,以不再像父母这样辛劳。穆拉德在12岁时就树立成为一名医生的理想,但“事与愿违”的是,穆拉德后来的工作比父母时间更长且更努力,区别在于不再是仅仅为了生计。
高中毕业后,穆拉德面临一大抉择。由于家庭难以承担高额学费,因此他需要寻找一所能够提供高额奖学金的大学。穆拉德最初决定考取免费的海军学院或西点军校,但这些学校不讲授医学课程,毕业后的四年兵役会耽搁医学深造。他最终选择迪堡大学(DePauw University)。迪堡大学是一所小型而优秀的文理大学,学校为穆拉德提供一份奖学金保障其完成学业,这里开设生物学和化学等医学相关课程,为他进一步医学深造提供了便利。
1957年,大四的穆拉德准备申请医学院,最初决定去位于圣路易斯的华盛顿大学医学院,随后两个人的建议让他彻底改变了主意。一位是穆拉德大学期间选修科研时的导师福斯特·富勒(Forst Fuller),建议他考虑西储大学(Case Western Reserve University)新开设的基础和临床联合七年制医学博士课程;另一位是挚友比尔·萨瑟兰(Bill Sutherland)的父亲厄尔·萨瑟兰(Earl Wilbur Sutherland),他是该课程的发起人和负责人,为穆拉德更详细地介绍了课程优点,包括免除学费外加每月2000美元津贴,诱人条件使穆拉德最终选择西储大学。
二
师出无名
在穆拉德进入西储大学前,厄尔·萨瑟兰已取得一项重大发现。1957年,萨瑟兰和助手西奥多·拉尔(Theodore Rall)研究肾上腺素促进糖原分解机制时发现,把肾上腺素添加到完整肝匀浆可促进糖原分解;然后将肝匀浆离心分离成上清液(细胞质部分)和沉淀(细胞膜部分)两部分后,仅将肾上腺素再次加入上清液中,未发现肝糖原分解明显增加,但重新加入沉淀后,糖原分解活性恢复,这一结果表明细胞膜是肾上腺素发挥生理活性所必备的。他们进一步使用肾上腺素处理细胞膜沉淀,同时补充能量分子ATP后生成一种耐热小分子物质,将该物质直接加入(不使用肾上腺素)上清部分也可增加糖原分解,最终确定该物质为环腺苷酸(cyclic adenosine 3'5'-monophosphate,cAMP)。萨瑟兰在此发现基础上提出著名的“第二信使假说”,即激素作用于细胞膜特定受体并激活腺苷酸环化酶(adenylate cyclase,AC)生成cAMP,cAMP进一步发挥活性实现生理效应;在这里激素是第一信使,cAMP为第二信使。萨瑟兰因这一贡献获得1971年诺贝尔生理学或医学奖。
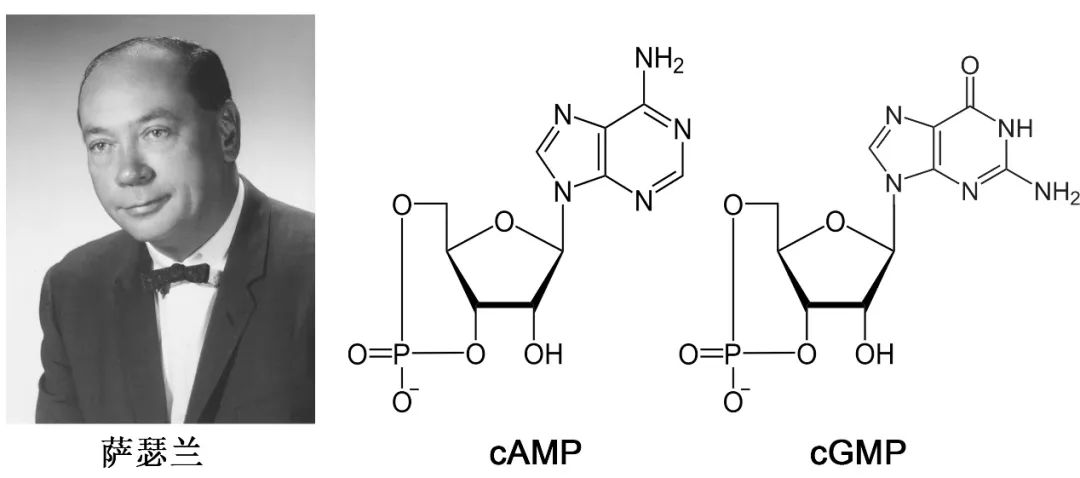
萨瑟兰的重大发现
萨瑟兰和拉尔联合指导穆拉德从事cAMP研究。穆拉德任务是探索儿茶酚胺对cAMP形成的影响。在此过程中,他发现乙酰胆碱可抑制腺苷酸环化酶,从而减少cAMP生成,这是首次描述激素对cAMP的负调控,第二信使假说内容更为丰富了。当时,第二信使假说领域快速发展,穆拉德作为见证者几乎每天能看到新进展和新发现;他也是参与者,并激发出巨大科研兴趣,最终放弃了原本的医生梦。另一方面,从这些研究中,他熟练掌握了cAMP及其他相似化合物的检测方法,为将来科研打下了良好基础。
1963年,萨瑟兰在尿液中发现一种和cAMP结构高度相似的小分子cGMP(环鸟苷酸),随后发现其广泛存在。萨瑟兰最初推测二者同样重要,但事实并非如此:用作研究的激素都通过cAMP介导反应,均不依赖cGMP,这便留下一个重要的未解之谜——cGMP的功能是什么?这一问题成为穆拉德将来的科研方向。
1965年,穆拉德获得博士学位后进入麻省总医院完成2年的实习工作,随后加入国立健康研究院从事三年多博士后工作。1970年,弗吉尼亚大学医学系新建一个临床药理部门,穆拉德加入并组建自己的科研小团队,开启独立研究。
三
平淡无奇
选择一个合适研究方向是穆拉德首先需要解决的问题,当时可选cAMP和cGMP两种分子,二者虽然结构极为相似,境遇却大相径庭——一个大红大紫、一个默默无闻;一个风光正盛、一个少人问津。穆拉德不想随波逐流,他秉持“天生我才”理念,既然细胞可产生cGMP,那cGMP就应有独特作用,只是目前尚未发现而已。
当时已知细胞有两类催化cGMP生成的鸟苷酸环化酶(GC),一类位于细胞膜,另一类位于细胞质。穆拉德选择位于细胞质的GC,实验设计较为简单,他将细胞进行破碎,离心去掉沉淀保留上清,然后观察不同物质对鸟苷酸环化酶活性的影响,方法是检测cGMP生成量(穆拉德已熟练掌握)。穆拉德短期内也不准备对酶进行纯化(较为耗时),因此使用粗制品进行研究,但需要将大量制备出的剩余样品及时储存。当时实验室最常用的蛋白保存试剂为叠氮化钠,对保存后的样品进行检测时,穆拉德意外发现鸟苷酸环化酶活性大幅度增加,cGMP生成量显著升高。这一意外发现使穆拉德十分惊讶,就把实验室可用的试剂依次进行测试,结果发现多种化合物如羟胺、苯肼和亚硝酸盐等也显著激活酶活性,它们拥有一个共同特征,那就是都含氮元素,深入分析发现它们激活鸟苷酸环化酶原因在于反应中生成了NO。
穆拉德还发现,这些物质不仅增加粗制品鸟苷酸环化酶活性,而且对完整细胞也具有活性。当使用这些化合物处理平滑肌细胞,可明显增加细胞内cGMP含量;重要的是,能进一步引起肌细胞舒张,而这是血管扩张的基本原理。因此,穆拉德决定进一步测试有实用价值的化合物,这些化合物要含氮并具有血管舒张活性,在此标准下他锁定治疗心绞痛的药物——硝酸甘油。
四
意外之喜
1847年,意大利化学家阿斯卡尼奥·索布雷洛(Ascanio Sobrero)首次在实验室制备出硝酸甘油(许多人都错误认为硝酸甘油由诺贝尔首先发现),这是一种挥发性极强且极易爆炸的液体(索布雷洛本人实验过程中伤痕累累);19世纪60年代,诺贝尔将硝酸甘油进行改进研制出固态炸药。令人意想不到的是,不久人们发现硝酸甘油可用于治疗心绞痛,后续又成功开发出单硝酸异山梨醇酯、硝普钠等多种药物,统称硝酸盐血管舒张剂,但药理一直不详。
1977年,穆拉德测试硝酸甘油,发现可增加血管平滑肌cGMP含量并引起肌肉松弛,原因在于它也可产生NO。这项研究有效解释了硝酸甘油等药物治疗心绞痛的药理机制,那就是生成NO生成后,由NO提升cGMP含量,从而实现平滑肌舒张。这一发现直接为新药研发指明方向。1986年,辉瑞公司设立研发小组筛选治疗心绞痛新药,原理是寻找磷脂酶5(该酶降解cGMP)抑制剂,最终得到西地那非。该药可有效增加cGMP浓度,具有扩张冠状动脉和抑制血栓形成的作用。随后临床试验却发现西地那非对心绞痛缓解作用非常有限,而意外观察到对男性勃起功能障碍有奇效,这一偶然发现促使神药“伟哥”诞生,穆拉德也因此获得“伟哥之父”的美誉。
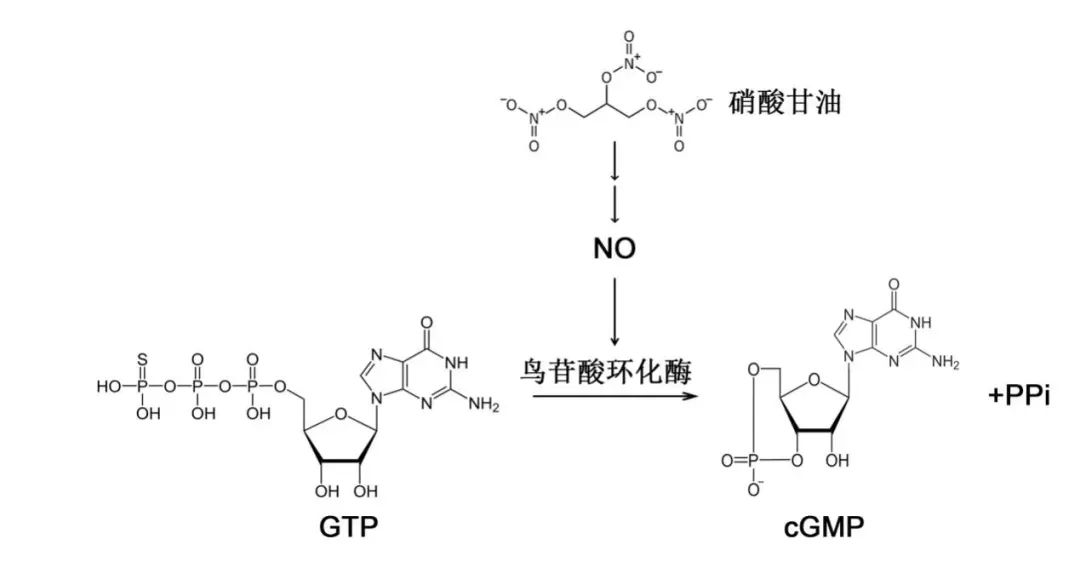
硝酸甘油、NO和cGMP
穆拉德的思想并未简单停留在硝酸甘油药理机制,而是进一步提出存在内源性NO,即正常细胞可在激素和神经递质等刺激下由自身含氮化合物产生NO,进而通过诱导cGMP生成发挥生理作用。按照推测,内源性NO含量既低,存在时间又短(这一特性避免其毒性发挥)。当时最先进技术都很难直接检测NO,一些证据间接证实内源NO存在,但并不太令人信服,因此迟迟未获科学界普遍接受,直到另一个偶然发现。
五
最佳助攻
20世纪50年代,纽约州立大学药理学家罗伯特·弗奇戈特(Robert Furchgott)研究血管扩张的原因,关注点是神经递质乙酰胆碱。将乙酰胆碱注射到动物体内可引起血管扩张和血压下降现象,因此他推测乙酰胆碱可引起血管中肌细胞舒张,从而增加血管直径。弗奇戈特让学生用体外实验验证这一推测,他们制备出一系列血管条,然后使用乙酰胆碱处理;如果血管条变长则意味着肌细胞舒张,奇怪的是结果重复性极差,更多情况下出现血管条变短现象,和预期完全相反,对这一现象一直无法解释。
1978年,弗奇戈特决定重新研究这个问题,这次实验者选择使用血管环,结果发现乙酰胆碱处理造成血管扩张,而且结果非常稳定。进一步分析发现,两次实验的差别就在使用的材料上,血管环不影响血管内部的内皮细胞,而血管条制备过程通常会破坏内皮细胞。对此,他们将血管环内部也去掉内皮细胞,结果用乙酰胆碱处理后,血管也不再扩张;制备保留内皮细胞的血管条用乙酰胆碱处理后则血管舒张,与之前的结果一致;甚至他们制备出三明治结构,那就是一条血管保留内皮,另一条去除,然后放置于一起(内皮细胞居中),用乙酰胆碱处理可造成两条血管均舒张。这一系列结果表明乙酰胆碱作用于肌细胞需内皮细胞生成一种特定中介物,弗奇戈特将其称为内皮来源舒张因子(EDRF)。弗奇戈特无法分离和确定EDRF是何种物质,但它的功能引起穆拉德的巨大兴趣,因此与弗奇戈特沟通准备合作研究,但由于其他原因而被耽搁。
六
殊途同归
EDRF的发现引起许多研究人员巨大兴趣,世界各地多家实验室都在尝试确定EDRF本质,后续研究惊奇地发现EDRF与NO具有极大相似性。
首先,EDRF和NO生理功能相似性。二者都会导致血管扩张,并且都通过激活鸟苷酸环化酶生成cGMP实现。这一点和其他证据促使穆拉德于1986年提出,EDRF就是内源NO。
其次,EDRF和NO化学性质相似性。两种物质半衰期都极短,并且都可影响血红素光谱吸收,且影响结果分毫不差,而测试的其他任何分子都不具备如此神奇效果。基于此,穆拉德认定EDRF就是NO。
1986年,弗奇戈特和加州大学洛杉矶分校的路易斯·伊格纳罗(Louis Ignarro)在第四届舒张血管机制国际研讨会上同时报道这项发现,遗憾的是大多数人并不相信他们的结果。但随后越来越多的证据支持EDRF和NO二者的一致性,科学界逐渐接受了这一事实。
1988年,研究人员证明精氨酸是体内NO生成的原料;1990年,研究人员在大脑中获得催化NO生成的酶,称为大脑NO合酶(bNOS),又称NOS-1;1991年,进一步发现内皮细胞NO合酶(eNOS),又称NOS-3;在巨噬细胞中发现诱导型NOS(iNOS),又称NOS-2。至此,三种NOS鉴定完毕,它们发挥不同生理功能,分别为舒张血管、抵抗感染和神经保护。至此,体内存在NO已成科学事实。
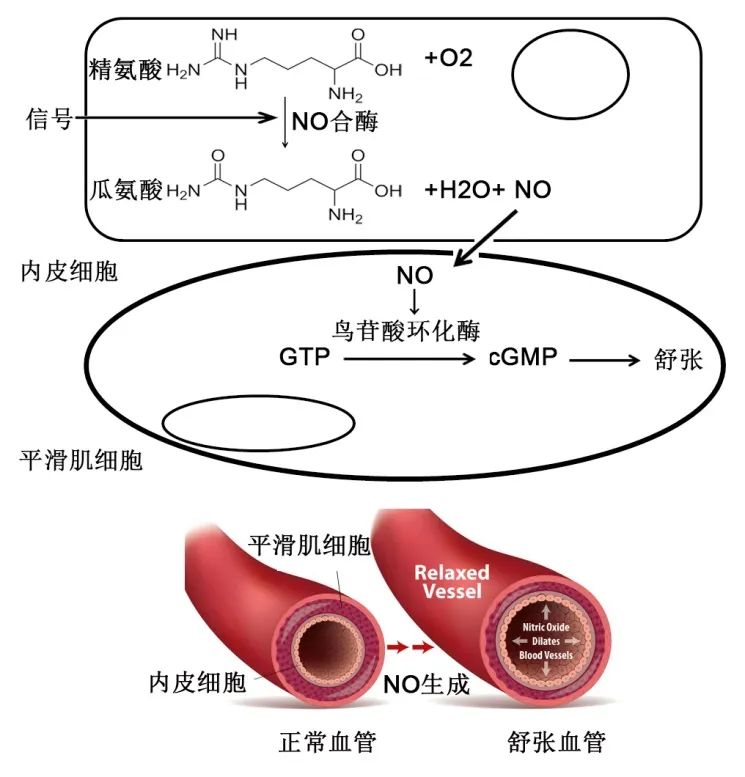
体内NO生成
七
功成名就
后续研究发现NO远比想象中更为重要,它参与了广泛的生物学过程,特别是作为动物体内第一种气体信号分子,为其他气体信号分子如CO、H2S等发现和研究提供重要思路,1992年,NO被《科学》杂志评为年度明星分子。
随着NO重要性日益显现,穆拉德也开始获得一系列科学奖励。1996年,穆拉德和弗奇戈特分享拉斯克基础医学奖;1998年,他们又和伊格纳罗分享诺贝尔生理学或医学奖。诺贝尔评奖委员会认为,穆拉德有关NO和cGMP的研究发现不仅诠释了一类古老药物的工作原理,而且还为许多生理现象理解和疾病治疗提供新思路。现在已知,NO在炎症形成、血液循环、组织发育、平滑肌舒张和长期记忆等过程均发挥重要作用,在心脏病、中风、癌症、肺部高血压等临床应用方面也具有重要潜力,如吸入NO治疗患有持续性肺动脉高压的早产儿。
八
老而弥坚
穆拉德一直挚爱着自己的科研事业,执着于揭示生命奥秘并期望能造福于人类。
1970年到1981年间,穆拉德在弗吉尼亚大学工作,于1975年成为学校最年轻教授之一,1971年成为临床研究中心主任和1973年临床药理学主任;他建立了一个临床和基础相结合的研究团队,取得科研成果的同时还培养了一大批青年人,他们成为科学发展的后备力量。1981年,穆拉德加入斯坦福大学,直到1989年。
为了能将科研成果更好转化,穆拉德于1988年加入雅培公司,担任副总裁,在随后的4年间开展新药研发和临床试验工作,大胆尝试一些疾病新疗法,遗憾的是未达自己预期而离职。1993年,穆拉德亲自成立一家生物技术公司,担任总裁兼首席执行官,在未能筹备到足够资金而自己的投入又花费殆尽的情况下,创业中道崩殂。
1997年,穆拉德重回学术界,加入得克萨斯大学休斯敦分校,再次开展基础研究。获得诺贝尔奖后,穆拉德日程变得繁忙起来,需要参与多种社交活动,因此有机会推广自己的学术理念。穆拉德精力旺盛,在多家单位开展广泛的研究,2011年时仍加入华盛顿大学工作。
2023年9月4日,穆拉德在加利福尼亚州门洛帕克去世,享年86岁。
穆拉德科研生涯完美诠释了生命过程需要“NO(一氧化氮)”,而科研过程更需要 “NO(不)”。不拘泥传统思维、勇于向陈旧观念挑战应是伟大科学家的先天因素。
主要参考文献
[1] 郭晓强.内皮细胞舒血管因子的发现者——弗奇戈特.科学(上海), 2010, 62(3):45-48.
[2] Sharina I, Martin E. Ferid Murad (1936-2023), 2023, 382(6670):519.
[3] Murad F. Some highlights of a 47 year career in research. Cell Mol Life Sci, 2005, 62(1):1-3.
[4] Murad F. Discovery of some of the biological effects of nitric oxide and its role in cell signaling. Biosci Rep, 2004, 24(4-5):452-474.
[5] Steinhorn BS, Loscalzo J, Michel T. Nitroglycerin and Nitric Oxide--A Rondo of Themes in Cardiovascular Therapeutics. N Engl J Med, 2015, 373(3):277-280.
[6] Mittal CK, Kimura H, Murad F. Requirement for a macromolecular factor for sodium azide activation of guanulate cyclase. J Cyclic Nucleotide Res, 1975, 1(6):261-269.
[7] Kimura H, Mittal CK, Murad F. Activation of guanylate cyclase from rat liver and other tissues by sodium azide. J Biol Chem, 1975, 250(20):8016-8022.
[8] Katsuki S, Arnold W, Mittal C, Murad F. Stimulation of guanylate cyclase by sodium nitroprusside, nitroglycerin and nitric oxide in various tissue preparations and comparison to the effects of sodium azide and hydroxylamine. J Cyclic Nucleotide Res, 1977, 3(1):23-35.
[9] Katsuki S, Arnold WP, Murad F. Effects of sodium nitroprusside, nitroglycerin, and sodium azide on levels of cyclic nucleotides and mechanical activity of various tissues. J Cyclic Nucleotide Res, 1977, 3(4):239-247.
[10] Murad F. Cyclic guanosine monophosphate as a mediator of vasodilation. J Clin Invest, 1986, 78(1):1-5.
0
推荐




 京公网安备 11010502034662号
京公网安备 11010502034662号 